��98%��Ũ���ᣨ���ܶ�Ϊ1.84g/cm
3������100mL 1.0mol/Lϡ���ᣬ��ʵ�������У�
A��100mL��Ͳ B��������ƽ C�������� D��50mL����ƿ
E��10mL��Ͳ F����ͷ�ι� G��50mL�ձ� H��100mL����ƿ
��1������ȡŨ��������Ϊ
mL��
��2��ʵ��ʱѡ�õ������У�����ţ�
��3�����ƹ����У����������ʹ���ƽ��ƫ�ߵ��ǣ�����ţ�
�ٶ���ʱ���ӿ̶��߹۲�Һ��
������ƿʹ��ʱδ����
�۶��ݺ�ҡ�ȡ����ã�����Һ����ڿ̶��ߣ��ټ�����ˮ�����̶���
��4��������ƿʹ�÷����У����в�������ȷ���ǣ�����ţ�
A��ʹ������ƿǰ������Ƿ�©ˮ
B������ƿ������ˮϴ�������ô���Һ��ϴ
C�����������ƹ��������ƽ���̵���ֽ�ϣ�ȷ�����������ձ����ܽ⣬����ע������ƿ��
D����ȷ��ȡ��18.4mol?L
-1�����ᣬע����ʢ��30mLˮ��100mL������ƿ�У���ˮ���̶���
E�����ݺ�����ƿ������ʳָ��סƿ��������һֻ�ֵ���ָ��סƿ�ף�������ƿ��תҡ��
��5����ʵ������г����������Ӧ��δ�����
�ټ�����ˮ����̶���Լ1--2����ʱ��Ӧ
�ڼ�����ˮʱ���������˿̶��ߣ�Ӧ
��

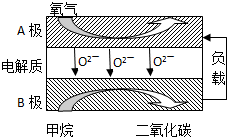 ��������Ȼ������Ҫ�ɷ֣�������������Ӧ�÷dz��㷺��һ�ֻ�ѧ���ʣ�
��������Ȼ������Ҫ�ɷ֣�������������Ӧ�÷dz��㷺��һ�ֻ�ѧ���ʣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�