
| A. | 可电解熔融MgCl2来制取金属镁,也能电解熔融HCl来制取Cl2 | |
| B. | 卤族元素的单质从F2到I2的熔点逐渐升高,则碱金属元素单质从Li到Cs的熔点也逐渐升高 | |
| C. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序是HCl>H2S>PH3 | |
| D. | 少量的Cl2通入FeBr2溶液中生成FeCl3和FeBr3,则少量的Cl2通入FeI2 溶液中也生成FeCl3和FeI3 |
分析 A.氯化镁为离子化合物,而氯化氢为共价化合物,熔融氯化氢不导电,无法电解熔融的HCl得到氯气;
B.同一主族元素中,随着原子序数的递增,非金属单质的沸点逐渐升高,而金属单质的沸点呈降低趋势;
C.同一周期元素的非金属性逐渐增强,非金属性越强,气态氢化物的稳定性越强;
D.铁离子能够氧化碘离子,溶液中不会存在FeI3.
解答 解:A.氯化镁属于离子化合物,可电解熔融MgCl2来制取金属镁,而HCl属于共价化合物,熔融HCl不导电,无法电解HCl获得氯气,故A错误;
B.卤素单质为非金属元素,其单质从F2到I2的熔点逐渐升高,而碱金属为金属族,碱金属元素单质从Li到Cs的熔点呈降低趋势,故B错误;
C.根据元素周期律可知,同一周期元素(稀有气体除外)的原子序数越大,非金属性越强,则对应的气态氢化物的稳定性越强,则第2周期元素氢化物稳定性顺序是:HF>H2O>NH3,第三周期元素氢化物稳定性顺序也满足:HCl>H2S>PH3,故C正确;
D.少量的Cl2通入FeBr2溶液中,亚铁离子的还原性大于溴离子,亚铁离子优先反应被氧化成铁离子,则反应生成FeCl3和FeBr3,而少量的Cl2通入FeI2溶液中,碘离子的还原性大于亚铁离子,则碘离子优先反应,碘离子反应完全后亚铁离子才反应,则溶液中不存在FeI3,故D错误;
故选C.
点评 本题考查了探究化学规律,题目难度中等,涉及元素周期律、氧化还原反应中氧化性、还原性强弱判断、电解原理的应用等知识,试题知识点较多,充分考查学生的分析能力、理解能力及灵活应用能力;D为易错点,注意明确碘离子与亚铁离子的还原性强弱.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液盛装在用橡胶塞的试剂瓶中 | |
| B. | 氢氟酸盛装在细口玻璃瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
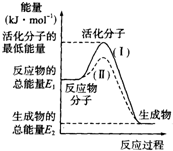 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3溶于少量的NaOH溶液中:HSO3-+OH-═SO32-+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: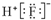 | |
| B. | 二氧化碳的结构式:O=C=O | |
| C. | Cl-离子的结构示意图: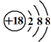 | |
| D. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com