
 一无色透明的溶液做如下实验:
一无色透明的溶液做如下实验:分析 因是“无色透明溶液”,该溶液中不能含有有色的Cu2+、Fe3+,
根据“取少量溶液滴加盐酸酸化的BaCl2溶液有白色沉淀生成”可知溶液中含有SO42-;
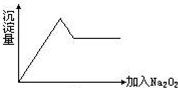
向溶液中加入过氧化钠,产生无色无味气体,说明该溶液中不含 NH4+,因为若有 NH4+,会与过氧化钠与水反应生成的氢氧化钠反应生成氨气,氨气具有刺激性气味.当向溶液中加入过氧化钠时,会生成白色沉淀,且沉淀量先增加后减少,但不会完全消失,说明溶液中含有Al3+、Mg2+;由于沉淀达到最大量后,加入过量的过氧化钠后沉淀立刻溶解,则溶液中一定不存在NH4+;
因此该溶液中一定存在的离子为:SO42-、Al3+、Mg2+,可能含有Na+、K+,一定不存在的离子为:Cu2+、Fe3+、NH4+,据此进行解答.
解答 解:(1)因是“无色透明溶液”,该溶液中不能含有有色的Cu2+、Fe3+,
根据“取少量溶液滴加盐酸酸化的BaCl2溶液有白色沉淀生成”可知溶液中含有SO42-;
向溶液中加入过氧化钠,产生无色无味气体,说明该溶液中不含 NH4+,因为若有 NH4+,会与过氧化钠与水反应生成的氢氧化钠反应生成氨气,氨气具有刺激性气味.当向溶液中加入过氧化钠时,会生成白色沉淀,且沉淀量先增加后减少,但不会完全消失,说明溶液中含有Al3+、Mg2+;由于沉淀达到最大量后,加入过量的过氧化钠后沉淀立刻溶解,则溶液中一定不存在NH4+,
因此该溶液中一定存在的离子为:SO42-、Al3+、Mg2+,可能含有Na+、K+,一定不存在的离子为:Cu2+、Fe3+、NH4+,
故答案为:SO42-、Al3+、Mg2+;Na+、K+;Cu2+、Fe3+、NH4+;
(2)溶液中一定含有的离子为SO42-、Al3+、Mg2+,所以至少存在的物质为:Al2(SO4)3、MgSO4,
故答案为:Al2(SO4)3、MgSO4.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,根据图象确定铵根离子的存在情况为易错点.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:选择题
| A. | T℃时,KW=1.0×10-12.该温度下,PH=3的溶液中,水电离出的c(H+)=1.0×10-11 | |
| B. | 25℃时,PH=a的氨水与PH=b的盐酸等体积混合至溶液呈中性,则a+b=14 | |
| C. | 0.1mol/LNaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.05mol/LNaOH溶液等体积混合,所得溶液中,2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ′
′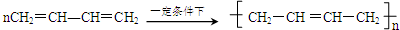 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 柠檬在味觉上有酸味,一定含强酸性物质 | |
| B. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | PM2.5中含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3→NH3+HNO3 | B. | NH4NO3→O2+HNO3+H2O | ||
| C. | NH4NO3→N2+O2+H2O | D. | NH4NO3→N2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
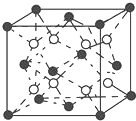 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com