
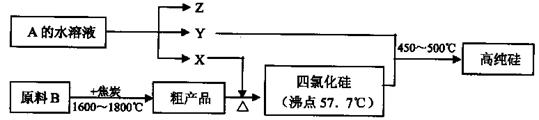
 Si3N4;方法一所得产品中混有硅或方法二除产品是固体外其它物质均为气体;HCl(1分),NH3(1分)
Si3N4;方法一所得产品中混有硅或方法二除产品是固体外其它物质均为气体;HCl(1分),NH3(1分)  Si + 2CO↑
Si + 2CO↑

科目:高中化学 来源:不详 题型:填空题
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
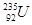 发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.作为燃料,为炼铁中的化学反应反应(删去)提供能量 |
| B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 |
| C.对高炉中的物料起到支撑和疏散的作用 |
| D.作为熔剂,除去铁矿石中的杂质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
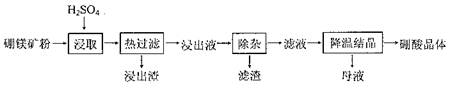
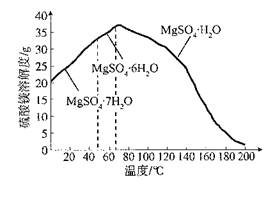
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
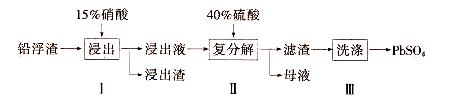
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.人类目前直接利用的能量大部分是由化学反应产生的 |
| B.煤、石油、天然气是当今世界重要的三种化石燃料 |
| C.我国目前最主要的能源是煤炭 |
| D.人体运动所消耗的能量与化学反应无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
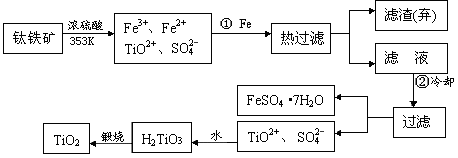
 TiCl4
TiCl4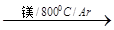 Ti
Ti 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com