
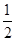 O2(g)=H2O(g)£»”÷H=Ņ»24l.8kJ/molĻĀĮŠĖµ·ØÖŠ“ķĪóµÄŹĒ
O2(g)=H2O(g)£»”÷H=Ņ»24l.8kJ/molĻĀĮŠĖµ·ØÖŠ“ķĪóµÄŹĒ| A£®H2µÄČ¼ÉÕČČĪŖ241.8kJ/mol |
| B£®2H2(g)+O2(g)=2H2O(g)£»”÷H=-483.6kJ/mol |
| C£®1mol H2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®·Å³öµÄČČĮæ“óÓŚ24l.8kJ |
| D£®¶ĻæŖ1molH2OµÄ»Æѧ¼üĪüŹÕµÄ×ÜÄÜĮæ“óÓŚ¶ĻĮŃlmolH2ŗĶ0.5molO2µÄ»Æѧ¼üĖłĪüŹÕµÄ×ÜÄÜĮæ |
 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Į½ÖÖČÜŅŗÖŠ£¬ÓÉĖ®µēĄė³öµÄĒāĄė×ÓÅØ¶Č¾łĪŖ1”Į10£11mol”¤L£1 |
| B£®·Ö±š¼ÓĖ®Ļ”ŹĶ100±¶ŗó£¬Į½ÖÖČÜŅŗµÄpHČŌĻąĶ¬ |
| C£®“×ĖįÖŠµÄc(CH3COO£)ŗĶĮņĖįÖŠµÄc(SO42£)ĻąµČ |
| D£®·Ö±š¼ÓČė×ćĮæŠæʬ£¬Į½ÖÖČÜŅŗÉś³ÉH2µÄĢå»żĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®HClČÜŅŗ | B£®NaOHČÜŅŗ | C£®Na2SO4ČÜŅŗ | D£®°±Ė® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 ӣ
ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Į½ČÜŅŗµÄĪļÖŹµÄĮæÅضČĻąĶ¬ |
| B£®ÓĆĶ¬ÅØ¶ČµÄŃĪĖįÖŠŗĶŹ±£¬ĻūŗÄŃĪĖįµÄĢå»żĻąĶ¬ |
| C£®ÉżøßĪĀ¶Č10”ę£¬Į½ČÜŅŗµÄpHČŌĻąµČ |
| D£®Į½ČÜŅŗÖŠOH£Ąė×ÓÅضČĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®CH3COOH | B£®Al2(SO4)3 | C£®NaHSO4 | D£®Na2CO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®1 | B£®10-14-a-b /¦Į | C£®10a+b-14/¦Į | D£®10a-b/¦Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®øĆČÜŅŗµÄpHÖµæÉÄÜĪŖ1 | B£®Ė®µÄµēĄėŹÜµ½“Ł½ų |
| C£®Ė®µÄĄė×Ó»ż½«±äŠ” | D£®øĆČÜŅŗµÄpHÖµŅ»¶ØĪŖ13 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 OH£)ĪŖ
OH£)ĪŖ| A£®2.0”Į10£7 mol”¤L£1 | B£®0.1”Į10£7 mol”¤L£1 |
| C£®1.0”Į10£14/2.0”Į10£7 mol”¤L£1 | D£®ĪŽ·ØČ·¶Ø |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com