
分析 (1)根据总反应方程式:4NH3+8O2=4HNO3+4H2O,即NH3+2O2=HNO3+H2O来计算;
(2)根据蒸馏过程中被蒸馏的水的质量,分别找出硝酸与硝酸镁中转移的水的等量关系,分别求出 M1、M2,进行分析解答本题;
(3)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答 解:(1)把两个化学方程式相加:得:4NH3+8O2=4HNO3+4H2O,再去掉一个公约数4简化为:
NH3 +2O2 =HNO3 +H2O
17 63 18
1.7t X Y
X=6.3t Y=1.8t
质量分数要为50%,则整个溶液的质量为6.3吨/50%=12.6吨,所需要加的水的质量为:12.6-6.3-1.8=4.5吨,
故答案为:4.5;
(2)设被转移的水的质量为X,
50%的硝酸含水量为50%,80%的硝酸镁溶液含水量为20%,90%的硝酸含水量为10%,60%的硝酸镁溶液含水量为40%.则
硝酸中水:0.5M1-X=(M1-X)×0.1
解得:M1=$\frac{9}{4}$X
硝酸镁中水:0.2M2+X=(M2+X)×0.4
解得:M2=3X
故$\frac{{M}_{1}}{{M}_{2}}$=$\frac{9X}{4×3X}$=$\frac{3}{4}$=0.75,
故答案为:0.75;
(3)设NO的物质的量是x,NO2的物质的量是y,则
x+$\frac{y-x}{2}$=$\frac{22.4}{22.4}$mol=1mol;
32x+24(y-x)=44,
解得:x=$\frac{1}{4}$mol,y=$\frac{7}{4}$mol,即一氧化氮和二氧化氮的物质的量之比$\frac{\frac{1}{4}}{\frac{7}{4}}$=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,
故答案为:1:7.
点评 本题主要考查了化学计算,注意平时知识的积累以及灵活应用是解题的关键,难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ⑤②③①⑥④⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤②①③④⑥⑦ | D. | ⑤③②①⑥④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
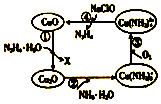 水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.
水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
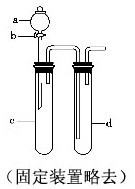 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量6mol•L-1的盐酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加入少量铜粉 | D. | 加入少量金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数为0.3 NA | |
| D. | 1 mol Na2O2与足量CO2反应转移的电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
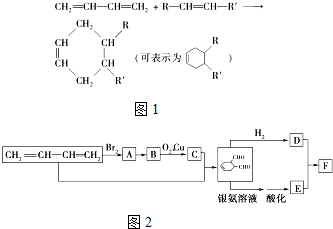
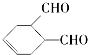 中含氧官能团的名称是醛基
中含氧官能团的名称是醛基 OHCCH=CHCHO+2H2O.
OHCCH=CHCHO+2H2O. .
. 、HC≡CCOOCH3.
、HC≡CCOOCH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com