
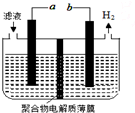
 某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )
某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )| A. | 过滤得到的沉淀可能是FeS | |
| B. | 与a极相连的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 可以用Fe与外接电源的a极相连 | |
| D. | 若有0.1mol电子发生转移,则一定能得到1.12LH2 |
分析 A.H2S被铁离子氧化为S;
B.与a极相连的电极上亚铁离子失电子生成铁离子;
C.Fe与外接电源的a极相连,Fe失电子,而溶液中的离子不反应;
D.在标准状况下,有0.1mol电子发生转移,会生成0.05mol氢气.
解答 解:A.将H2S通入FeCl3溶液中,H2S被铁离子氧化为S,即发生2Fe3++H2S=S↓+2Fe2++2H+,所以过滤得到的沉淀是S沉淀,故A错误;
B.与b 相连的电极上氢离子得电子生成氢气,则为阴极,所以与a极相连的电极为阳极,阳极上亚铁离子失电子生成铁离子,即电极反应式为Fe2+-e-═Fe3+,故B正确;
C.Fe与外接电源的a极相连,Fe作阳极失电子,而溶液中的亚铁离子不反应,所以不能用Fe作电极,故C错误;
D.电极反应2H++2e-=H2↑,有0.1mol电子发生转移,会生成0.05mol氢气,在标准状况下,氢气的体积为1.12L,但是选项中没有说明是标准状况下,所以无法确定氢气的体积,故D错误.
故选B.
点评 本题考查了氧化还原反应、电解原理的应用,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握电极的判断方法和电解方程式的书写方法.


科目:高中化学 来源: 题型:选择题
| A. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| B. | 碳酸钠可作为治疗胃酸过多的药物,食品发酵剂 | |
| C. | 通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体 | |
| D. | 焰色反应一定伴随着化学变化和物理过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | C2H4、C3H6和  中均含有碳碳双键 中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
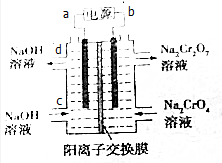 已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )
已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )| A. | CrO42-生成Cr2O72-的反应为非氧化还原反应,不能通过电解方法获得 | |
| B. | a为电源正极 | |
| C. | d口流出的NaOH溶液的浓度与c口通入的NaOH溶液的浓度相同 | |
| D. | Na+从右侧通过阳离子交换膜进入左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
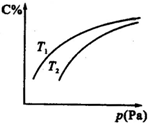
| A. | B一定为气体 | |
| B. | A一定为气体 | |
| C. | 若正反应方向△H<0,则T1>T2 | |
| D. | 压强增大时,混合气体的平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2→NH3→NO→NO2→HNO3→NO | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com