
| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列实验方法或装置正确的是( )

A. 用图1所示装置制取乙烯
B. 用图2所示方法验证HCl气体易溶于水
C. 用图3所示方法探究固体表面积对反应速率的影响
D. 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应在任何温度下都能自发进行 | |
| B. | 此反应仅在低温下自发进行 | |
| C. | 此反应仅在高温下自发进行 | |
| D. | 此反应在任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2的比例模型: | |
| B. | 甲烷的电子式 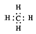 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子构成${\;}_6^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①②④有尽有 | C. | 只有①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和盐酸反应 CO32-+2H+=H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液 Ba2++SO42-=BaSO4↓ | |
| C. | 碳酸氢钙溶液与盐酸溶液反应 HCO3-+H+=H2O+CO2↑ | |
| D. | 向稀盐酸溶液中加铁粉 3Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
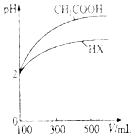 水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3x10-7,K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com