
【题目】已知 25℃下时,NH3·H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11。 25℃时有关NH4HCO3溶液的说法中正确的是
A. 呈弱酸性
B. c(OH-)+c(NH3·H2O)=c(H+)+c(H2CO3)
C. 滴入NaOH 溶液发生反应:NH4++OH-=NH3·H2O和HCO3-+OH-=H2O+CO32-
D. 滴入NaOH溶液,则![]() 增大
增大
【答案】C
【解析】A.分析电离平衡常数可知电离程度,NH3H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,溶液中c(OH-)>c(H+),NH4HCO3溶液呈碱性,故A正确;B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),物料守恒:c(NH4+)+c(NH3H2O)=c(CO32-)+c(HCO3-)+c(H2CO3),将c(NH4+)等量替换后得c(NH3H2O)+c(OH-)=c(HCO3-)+c(OH-)+2c(H2CO3),故B错误;C.NH4HCO3溶液中存在NH4+、HCO3-均能与OH-发生离子反应,故C正确;D. 滴入NaOH溶液,不影响NH4+的水解平衡常数,即![]() 不变,故D错误;答案为C。
不变,故D错误;答案为C。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡炳成教授团队经过多年的刻苦钻研,通过氧化断裂的方式选择性地切断芳基五唑分子中 的C-N键(如图)首次制得室温下稳定的含能材料(N5)6(H3O)3(NH4)4Cl(PHAC),热分析结果显示PHAC分解温度高达116.8℃,具有非常好的热稳定性。
下列说法错误的是

A. 反应表明拆开N-C键比N-N键容易 B. ![]() 属于芳香醇的异构体有5种
属于芳香醇的异构体有5种
C. PHAC是一种酸式盐 D. PHAC能用于制造高能炸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
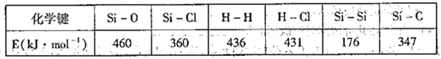
工业上高纯硅可通过下列反制取:SiCl4(g) +2H2(g)= Si(g) +4HCl(g),(已知 lmol晶体Si中2molSi -Si键),该反应产生的热量为
A. 吸收45kJ mo1-1 B. 放出412 kJ mo1-1
C. 吸收 236 kJ mo1-1 D. 放出236 kJ mo1-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中含量占第一、二位的元素之间形成的化合物不具有的性质是( )
A. 常温下与水反应生成酸 B. 高温时能与CaO、CaCO3反应
C. 常温下能与苛性钠反应 D. 常温时能与氢氟酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学科学家将古老的养蚕技术与碳纳米管和石墨烯结合,获得了更加牢固的蚕丝纤维,其延展性、抗拉强度显著提高,通过高温加热碳化还可显著提高导电性。下列有关说法正确的是
A. 石墨烯具有良好的导电性能,所以石墨烯基锂电池具有独特优势
B. 蚕丝纤维属于纯净物
C. 石墨烯属于烯烃
D. 蚕丝纤维加热碳化后具有导电性是因为所有碳单质都具有良好的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧盟征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢碳纳米管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,请完成并配平下述化学方程式:
口C+口K2Cr2O7+口______=口CO2↑+口K2SO4+口Cr2(SO4)3+口H2O
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=-116kJ/mol
①下列措施中有利于增大该反应的反应速率的是_______(填字母代号)。
A.随时将CH30H与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ/mol
则表示lmol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________。
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃ 三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。

请回答:
i)在上述三种温度中,曲线Z对应的温度是_________;
ii)利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)=CH3OH(g)的平衡常数K=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com