
【题目】X、Y、Z、E、M、Q、R为七种短周期的主族元素,它们的原子序数依次增大,其中X+无电子,Y、Z同一周期且相邻,X与E、Z与Q分别为同一主族,M的原子序数是Y的2倍,Q的质子数比E多5。J为ds区原子序数最小的元素。请用推断出的元素回答下列问题:
(1)Y、Z、Q三元素的第一电离能由大到小的顺序为__________,Y2 、X2分子中共价键的数目之比为_________,MR4分子的中心原子的杂化轨道类型是_______。
(2)由Q、R两元素可按原子个数比l:l组成化合物T,化合物T中各原子均满足8电子的稳定结构,则T的电子式为________。固体化合物E2Z2投人到化合物E2Q的水溶液中,只观察到有沉淀产生,该反应的离子方程式为______________________。
(3)J元素基态原子的外围电子排布式为___________。向JQZ4溶液中逐滴加人Y元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解得到深蓝色的透明溶液,该沉淀溶解的离子方程式是_____________。
(4)J2Z为半导体材料,在其立方晶胞内部有4个Z原子,其余Z原子位于面心和顶点,则该晶胞中有______个J原子。
【答案】(1)N>O>S;3:1;sp3;(2)![]() ;Na2O2+S2-+2H2O=S+2Na++4OH-;
;Na2O2+S2-+2H2O=S+2Na++4OH-;
(3)3d104s1;Cu(OH)2+4NH3H2O =[Cu(NH3)4]2++2OH-+ 4H2O;(4)16
【解析】
试题根据题意可推知:X是H;Y是N;Z是O;E是Na;M是Si;Q是S;R是Cl;J是Cu。(1)一般情况下同一周期的元素,原子序数越大,元素的第一电离能就越大,但是由于N原子的最外层电子处于半充满的稳定状态,失去电子比O还难,所以第一电离能N>O,O、S是同一主族的元素,由于从上到下元素核外电子层数逐渐增多,所以失去电子越来越容易,因此第一电离能O>S,因此Y、Z、Q三元素的第一电离能由大到小的顺序为N>O>S;在N2分子中2个N原子共用三对电子,在H2分子中2个H原子共用1对电子,因此这两种分子中的共价键的数目之比为3:1;在SiCl4分子的中心Si原子的杂化轨道类型是sp3杂化;(2)由Q、R两元素可按原子个数比l:l组成化合物T,化合物T中各原子均满足8电子的稳定结构,则T的分子式是S2Cl2,电子式为![]() 。固体化合物E2Z2投人到化合物E2Q的水溶液中,只观察到有沉淀产生,由于Na2O2有氧化性,而Na2S有还原性,所以二者发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒可得反应的离子方程式是:Na2O2+S2-+2H2O=S+2Na++4OH-;(3)29号元素J元素基态原子的外围电子排布式为3d104s1;向JQZ4溶液中逐滴加人Y元素氢化物的水溶液,先生成蓝色沉淀,发生反应:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+;当氨水过量时,继续发生反应:Cu(OH)2+4NH3H2O =[Cu(NH3)4]2++2OH-+ 4H2O;(4)J2Z为半导体材料,在其立方晶胞内部有4个Z原子,在其余Z原子位于面心和顶点,则一个晶胞中含有O原子的个数是:4+8×1/8+6×1/2=8,由于n(Cu):n(O)=2:1,所以n(Cu)=2×8=16.即该晶胞中有16个J原子。
。固体化合物E2Z2投人到化合物E2Q的水溶液中,只观察到有沉淀产生,由于Na2O2有氧化性,而Na2S有还原性,所以二者发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒可得反应的离子方程式是:Na2O2+S2-+2H2O=S+2Na++4OH-;(3)29号元素J元素基态原子的外围电子排布式为3d104s1;向JQZ4溶液中逐滴加人Y元素氢化物的水溶液,先生成蓝色沉淀,发生反应:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+;当氨水过量时,继续发生反应:Cu(OH)2+4NH3H2O =[Cu(NH3)4]2++2OH-+ 4H2O;(4)J2Z为半导体材料,在其立方晶胞内部有4个Z原子,在其余Z原子位于面心和顶点,则一个晶胞中含有O原子的个数是:4+8×1/8+6×1/2=8,由于n(Cu):n(O)=2:1,所以n(Cu)=2×8=16.即该晶胞中有16个J原子。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 在水玻璃溶液中通入少量CO2:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
B. 向0.1L5mol·L-1亚硫酸氢铵溶液中逐滴加入0.1L7mol·L-1 NaOH溶液:2NH![]() +5HSO3-+7OH-===2NH3·H2O+5SO
+5HSO3-+7OH-===2NH3·H2O+5SO![]() +5H2O
+5H2O
C. Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
D. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+2H2O+4NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能与银氨溶液反应析出银,如果条件控制适当,析出的银会均匀分布在试管上,形成光亮的银镜,这个反应叫银镜反应。某实验小组对银镜反应产生兴趣,进行了以下实验。
(1)配制银氨溶液时,随着硝酸银溶液滴加到氨水中,观察到先产生灰白色沉淀,而后沉淀消失,形成无色透明的溶液。该过程可能发生的反应有_________
A. AgNO3+NH3·H2O=AgOH↓+NH4NO3 B. AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
C. 2AgOH=Ag2O+H2O D. Ag2O+4NH3·H2O=Ag(NH3)2OH+3H2O
(2)该小组探究乙醛发生银镜反应的最佳条件,部分实验数据如表:
实验 序号 | 银氨溶液/mL | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
4 | 1 | 3 | 50 | 11 | 6 |
请回答下列问题:
①推测当银氨溶液的量为1 mL,乙醛的量为3滴,水浴温度为60℃,反应混合液pH为11时,出现银镜的时间范围是____________________。
②进一步实验还可探索_______________对出现银镜快慢的影响(写一条即可)。
(3)该小组查阅资料发现强碱条件下,加热银氨溶液也可以析出银镜,并做了以下两组实验进行分析证明。已知:Ag(NH3)2++2H2O![]() Ag++2NH3·H2O。
Ag++2NH3·H2O。
装置 | 实验序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 2 mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
实验Ⅱ | 2 mL银氨溶液和数滴浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |
①两组实验产生的气体相同,该气体化学式为____________,检验该气体可用____________试纸。
②实验Ⅰ的黑色固体中有Ag2O,产生Ag2O的原因是____________。
(4)该小组同学在清洗试管上的银镜时,发现用FeCl3溶液清洗的效果优于Fe2(SO4)3溶液,推测可能的原因是____________,实验室中,我们常选用稀HNO3清洗试管上的银镜,写出Ag与稀HNO3反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期科学家报告了一种直接电化学合成H2O2的方法,装置如图。下列叙述不正确的是( )
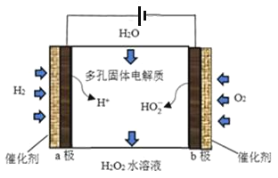
A.该装置的工作原理是将化学能转化成电能
B.b极发生的电极反应为O2+H2O+2e-=HO2-+OH-
C.电池工作时,内部发生反应:HO2-+OH-+2H+=H2O2+H2O
D.电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸的熔点为122.13℃,微溶于水,易溶于酒精,实验室制备少量苯甲酸的流程如图:
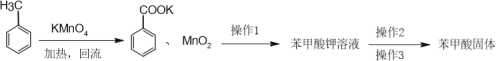
下列叙述不正确的是( )
A.冷凝回流的目的是提高甲苯的转化率
B.加入KMnO4反应后紫色变浅或消失,有浑浊生成
C.操作1为过滤,操作2为酸化,操作3为过滤
D.得到的苯甲酸固体用酒精洗涤比用水洗涤好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,H2O只作还原剂的是
A.2H2O![]() 2H2↑+O2↑B.2F2+2H2O=4HF+O2
2H2↑+O2↑B.2F2+2H2O=4HF+O2
C.CaO+ H2O=Ca(OH)2D.2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔奖授予JohnB.Goodenough等三位科学家,以表彰其在锂电池领域的贡献。磷酸亚铁锂(LiFePO4)用作锂离子电池正极材料,制备方法如图:

(1)制备水合磷酸铁(FePO4·xH2O)固体
①过程Ⅰ,加NaOH溶液调pH=2.0时透明混合溶液中含磷微粒主要是H2PO4-,过程Ⅰ发生的主要离子方程式是____。
②过程Ⅱ“氧化、沉淀”反应生成FePO4沉淀的离子方程式是____。
③进行过程III之前,需确认过程II中无Fe2+,检验试剂为____。
④FePO4·xH2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图:

水合磷酸铁的化学式为____。(x取整数)
(2)制备LiFePO4固体:
在氮气气氛保护下,高温焙烧FePO4、Li2CO3和过量葡萄糖的固体混合物。
①过量葡萄糖作用是____。
②锂离子电池在充电时,电极材料LiFePO4会迁出部分Li+,部分转变为Li(1-x)FePO4。此电极的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表信息(部分短周期元素的原子半径及主要化合价)可知,下列叙述正确的是
元素代号 | A | B | C | D | E |
原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.离子半径大小:![]()
B.![]() 与
与![]() 的核外电子数不可能相等
的核外电子数不可能相等
C.最高价氧化物对应水化物的碱性:A<C
D.氢化物的稳定性:D>E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有的氯化镁是镁的重要来源之一。从海水中制取镁有多种生产方法,可按如下步骤进行:
①把贝壳制成石灰乳
②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解
关于从海水中提取镁的下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富
B. 进行①②③步骤的目的是从海水中提取氯化镁
C. 以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
D. 第④步电解制镁是由于镁是很活泼的金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com