
分析 (1)有自由移动的电子或离子的物质能导电;
(2)在水溶液中或熔融状态下能导电的化合物为电解质,常见的电解质有酸、碱、盐、金属氧化物和水等,据此分析.
解答 解:①蔗糖不能导电,是非电解质;
②熔融NaCl有自由移动的离子,能导电,是电解质;
③盐酸能导电,但是混合物,故不是电解质;
④铜丝能导电,但是单质,故不是电解质;
⑤NaOH固体 不能导电,但是电解质;
⑥液态HCl不能导电,是电解质;
⑦H2SO4不能导电,是电解质;
⑧CO2不能导电,是非电解质;
⑨食盐水能导电,是混合物,故不是电解质.
(1)能导电的有②③④⑨,故答案为:②③④⑨;
(2)是电解质的是②⑤⑥⑦,故答案为:②⑤⑥⑦.
点评 本题考查了电解质和物质能否导电的判断,难度不大,应注意的是电解质不一定能导电,能导电的不一定是电解质.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.1mol/L的AlCl3溶液 | B. | 20mL0.2mol/L的CaCl2溶液 | ||
| C. | 30mL0.2mol/L的KCl溶液 | D. | 10mL0.25mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移(得失或偏移)的化学反应都是氧化还原反应 | |
| B. | p电子原子轨道的平均半径随电子层的增大而增大 | |
| C. | 电子是在原子核外,能量由低到高的不同电子层上分层排布的 | |
| D. | 氢原子电子云图中小黑点表示电子的运动轨迹 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
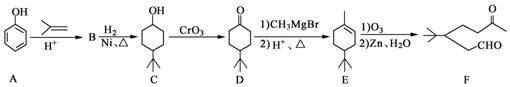
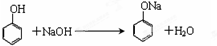 .
. ,A到B的反应类型为加成反应.
,A到B的反应类型为加成反应. (任写一种).
(任写一种).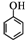 )和CH2=CH2为原料制备有机物 的
)和CH2=CH2为原料制备有机物 的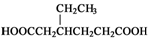 合成路线流程图(无机试剂任用).
合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液其PH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.l mol / L HCl溶液,溶液中c?H+?减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1 mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,若溶液pH<7,各离子浓度的关系为:
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com