
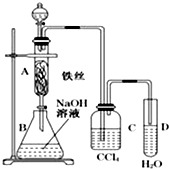
 某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.分析 (1)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫;
(2)A中铁丝的作用作催化剂;
(3)溴能与氢氧化钠反应而溴苯不能;
(4)CCl4 能溶解溴不能溶解溴化氢;苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成.
解答 解:(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:发生反应为:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr,
故答案为:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(2)苯与液溴发生在铁丝做催化剂条件下发生取代反应生成溴苯和溴化氢,
故答案为:作催化剂;
(3)氯气与NaOH溶液的反应:Cl2+2NaOH═NaCl+NaClO+H2O.将其中的“Cl”换成“Br”即得Br2与NaOH溶液反应的化学方程式,Br2+2NaOH═NaBr+NaBrO+H2O,由此可知实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,除去溶于溴苯中的溴,
故答案为:除去溶于溴苯中的溴;Br2+2NaOH═NaBr+NaBrO+H2O;
(4)CCl4能溶解溴不能溶解溴化氢,C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气,如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.也就是说,如果要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成.题目已经给出检验Br-的方案,我们再回答出检验H+的方法即可.但溴易挥发,溴化氢气体中的溴蒸气对溴化氢的检验有干扰作用,因此,在检验溴化氢前必须除去溴蒸气,这也正是C中盛放的CCl4的作用.
故答案为:除去溴化氢气体中的溴蒸气;石蕊试液;溶液变红色.
点评 本题考查苯的取代反应方程式及实验现象以及产物HBr的检验,题目难度中等,注意掌握苯的取代反应原理,明确反应的产物及HBr的化学性质进行解题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14 g丙烯和丁烯的混合气体含有的原子数为6NA | |
| B. | 25℃,pH=1的1 L H2SO4溶液含有的H+数目为0.2NA | |
| C. | 1 mol Fe与一定量的HNO3反应,转移的电子数目一定为3NA | |
| D. | 标准状况下,22.4 L NO和O2的混合气体中所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g ND3中所含分子数目NA | |
| B. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底 | |
| B. | 把乙烯通入溴水中,溴水立即褪色,这是由于乙烯具有漂白性 | |
| C. | 煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
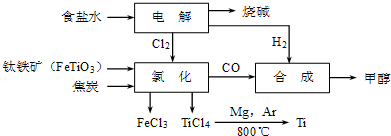
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①②④ | C. | ②③ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z三种元素的最简单氢化物中最不稳定的是Y | |
| B. | W、Y、Z三种元素对应氧化物的水化物一定都是强酸 | |
| C. | W、X元素的最简单氢化物都是非电解质 | |
| D. | Z元素的单质在化学反应中只能表现氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com