
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在0.01 mol·L-1Ba(OH)2溶液中:Al3+、NH4+、NO![]() 、HCO
、HCO![]()
B. 0.1 molL-1的FeCl2溶液中:H+、Al3+、SO42-、ClO-
C. 滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、I-
D. 由水电离产生的c(H+)=1×10-13mol·L-1的溶液中:Na+、Ba2+、NO![]() 、Cl-
、Cl-
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】离子方程式:CO![]() +2H+===CO2↑+H2O表示( )
+2H+===CO2↑+H2O表示( )
A. 碳酸盐和盐酸之间的反应
B. 一切碳酸盐与一切酸之间的反应
C. 可溶性碳酸盐与酸之间的反应
D. 可溶性碳酸盐与强酸之间的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①![]()
② ![]()
回答下列问题:
(1)A的化学名称是_________________。
(2)E的结构简式为______________________________。
(3)G为甲苯的同分异构体,由F生成H的化学方程式为_____________________。
(4)由C生成D和E生成F的反应类型分别是________、_________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出![]() ,其核磁共振氢谱显示有
,其核磁共振氢谱显示有![]() 种不同化学环境的氢,峰面积为
种不同化学环境的氢,峰面积为![]() ,写出
,写出![]() 种符合要求的X的结构简式____________、____________。
种符合要求的X的结构简式____________、____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物 的合成路线_______(其他试剂任选)。
的合成路线_______(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡水中学2017届第二次模拟考试】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
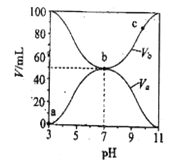
A.Ka(HA)=1×10-6mol/L
B.b点c (B+)=c(A-)=c(OH-)=c(H+)
C.c点时,![]() 随温度升高而减小
随温度升高而减小
D.a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将31.8gNa2CO3固体溶于水配成体积为1L的溶液,回答下列问题:
(1)该溶液中含有CO32-的数目是______________,Na+的浓度是___________mol/L
(2)现有某浓度的浓盐酸,该盐酸的密度d=1.2g/cm3,质量分数w = 36.5%,计算该盐酸的物质的量浓度是__mol/L。
(3)欲将题干中的Na2CO3完全反应生成CO2气体,则至少需要(2)中的盐酸_________mL,生成的CO2气体的体积是_________mL (标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯和聚乙烯都可以与溴水发生加成反应
B. 在浓硫酸作催化剂条件下,加热乙醇不一定得到乙烯
C. 苯酚在空气中显淡红色,并未变质
D. 甲苯最多有15个原子在同一个平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某物质的溶液中由水电离出的c(H+)=1×10-a molL-1,若a>7时,则该溶液的pH一定为14-a
B. 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3·H2O;c(NH4+)由大到小的顺序是:②>①>③>④
C. 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+) +c(H+) = c(S2-) +c (HS-)+c(OH-)
D. AgCl悬浊液中存在平衡: AgCl(s)![]() Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,Ksp减少
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,Ksp减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
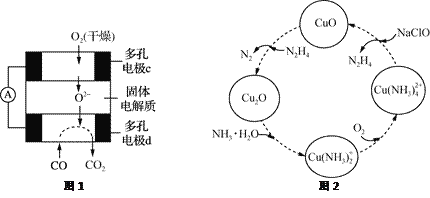
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
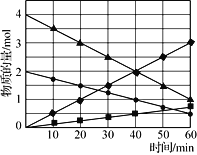
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com