
【题目】实验室可由![]() 、
、![]() 、
、![]() 为原料制备
为原料制备![]() ,若反应后废液中的
,若反应后废液中的![]() 排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有
排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有![]() 、
、![]() 、
、![]() 等。
等。
(1)已知![]() 化学式可表示为
化学式可表示为![]() ,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
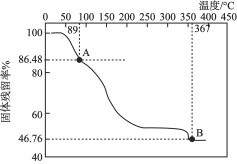
①写出起始状态到A点发生分解反应的化学方程式:________________。
②B点对应物质的化学式是______________。
(2)废水中![]() 和
和![]() 的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以
的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以![]() 和
和![]() 形式存在的氮元素转化为
形式存在的氮元素转化为![]() 除去。
除去。
①写出![]() 在正极发生的电极反应式______________。
在正极发生的电极反应式______________。
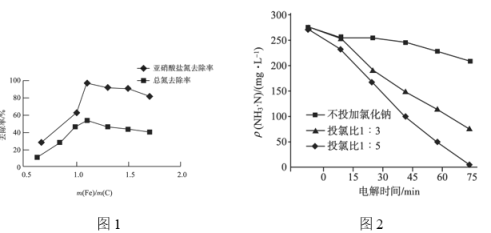
②不同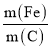 的脱氮效果如图1所示,则合适的
的脱氮效果如图1所示,则合适的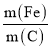 =________。
=________。
③实验测得当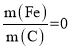 时,对废水中的氮也有一定的脱除率,其原因为________。
时,对废水中的氮也有一定的脱除率,其原因为________。
(3)废水中![]() 的处理。用电解法可对废水进行脱氮处理。
的处理。用电解法可对废水进行脱氮处理。
①电解时含氯离子转化为次氯酸,![]() 与
与![]() 反应生成
反应生成![]() ,当生成
,当生成![]() 时,转移的电子数为________mol。
时,转移的电子数为________mol。
②氯离子含量对废水脱氮效果的影响如图2所示,投氯比是指氨氮与氯离子物质的量的比,三种情况下投料为![]() 时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
【答案】![]()
![]()
![]()
![]() 之间均可 活性炭具有疏松多孔的结构,可吸附水中的
之间均可 活性炭具有疏松多孔的结构,可吸附水中的![]() 和
和![]() 6 最好 氯离子浓度大,电解反应速率快,相同时间内生成的
6 最好 氯离子浓度大,电解反应速率快,相同时间内生成的![]() 浓度大,氧化性强(其他合理答案也可赋分)
浓度大,氧化性强(其他合理答案也可赋分)
【解析】
(1)①根据计算起始点和A点分子量上相差144,刚好8个水分子;
②设B点物质化学式为![]() ,计算化学式。
,计算化学式。
(2)①酸性介质中多氧部分加氢生成![]() ,反应的离子方程式为
,反应的离子方程式为![]() ;②从题图中可以看出
;②从题图中可以看出![]() 时的脱氮效果最好;
时的脱氮效果最好;
③活性炭的结构疏松多孔,对水中的![]() 和
和![]() 有吸附作用。
有吸附作用。
(3)①次氯酸与氨气反应的方程式为![]() ;②从图中可以看出投氯比为
;②从图中可以看出投氯比为![]() 脱氮效果最好。
脱氮效果最好。
(1)已知![]() 化学式可表示为
化学式可表示为![]() ,由常温下逐渐升温的过程中会发生分解。起始状态到A点是失去了部分结晶水,①起始状态到A点分子量上相差144,刚好8个水分子,发生分解反应的化学方程式:
,由常温下逐渐升温的过程中会发生分解。起始状态到A点是失去了部分结晶水,①起始状态到A点分子量上相差144,刚好8个水分子,发生分解反应的化学方程式:![]() ;
;
②设B点物质化学式为![]() ,(51+16x)×6÷1065=0.4676,x=2,化学式为VO2;
,(51+16x)×6÷1065=0.4676,x=2,化学式为VO2;
(2)将酸性废水中以![]() 和
和![]() 形式存在的氮元素转化为
形式存在的氮元素转化为![]() 除去,正极发生还原反应,化合价降低,
除去,正极发生还原反应,化合价降低,![]() 在正极发生的电极反应式为
在正极发生的电极反应式为![]() ;
;
②由图中脱氮效果可知,则合适的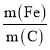 =
=![]() 之间均可;
之间均可;
③脱除率检测的是溶液中的元素含量,实验测得当 时,对废水中的氮也有一定的脱除率,其原因为活性炭具有疏松多孔的结构,可吸附水中的
时,对废水中的氮也有一定的脱除率,其原因为活性炭具有疏松多孔的结构,可吸附水中的![]() 和
和![]() ;
;
(3)①次氯酸与氨气反应的方程式为![]() ,当生成
,当生成![]() 时,转移的电子数为
时,转移的电子数为![]() ;
;
②根据氯离子含量对废水脱氮效果的影响,三种情况下投料为![]() 时脱氮效果最好,原因可能是氯离子浓度大,电解反应速率快,相同时间内生成的
时脱氮效果最好,原因可能是氯离子浓度大,电解反应速率快,相同时间内生成的![]() 浓度大,氧化性强。
浓度大,氧化性强。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL 0.1mol/L的KMnO4溶液,分别加入2mL 0.1mol/L和 0.2mol/L的H2C2O4(草酸 |
C | 证明乙醇的消去反应有乙烯生成 | 将含有浓硫酸的乙醇溶液迅速升温至170℃,将产生的气体直接通入酸性KMnO4溶液中 |
D | 验证醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
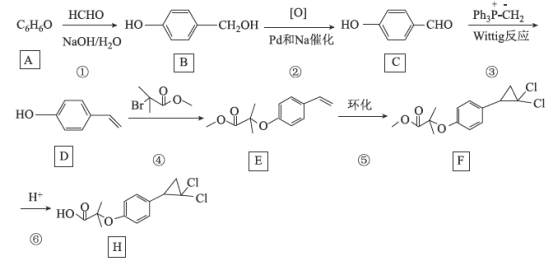
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() 。若溶液混合引起的体积变化可忽略,则室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,则室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
C.![]() 的
的![]() 和
和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 氨水和
氨水和![]() 溶液等体积混合:
溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。
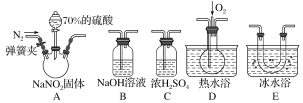
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________。
②装置E的作用是_________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气有下列反应:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(1)该反应中氧化剂是_____;被还原的元素是_______;氧化产物是 ______;
(2)用单线桥法标出电子转移的方向和数目______________;
(3)若该反应中有0.2mol的电子转移,则能生成标准状况下的氯气的体积是_______;
(4)若该反应有1molKMnO4参加反应,被氧化的HCl为______mol,转移电子数______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应生成另外两种气体,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
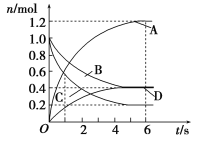
A. 该反应的化学方程式为3B(g)+4D(g)![]() 6A(g)+2C(g)
6A(g)+2C(g)
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。

请回答:
(1)虚线框处宜选择的装置是___(填“甲”或“乙”);实验时应将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是___。
(2)硬质玻璃管中铁和水蒸气反应的化学方程式为___(并用单线桥表示电子转移情况)。取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁,判断结论是否正确并用文字和离子方程式说明理由___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com