
分析 原子序数为11一18号元素为第三周期元素,从左向右金属性减弱,非金属性增强,Al的氧化物具有两性,且Al为地壳中含量最高的金属元素,HClO杀菌消毒,具有相同电子排布的离子中原子序数大的离子半径小,铝离子半径最小,稀有气体中不含化学键,以此来解答.
解答 解:原子序数为11一18号元素为第三周期元素,从左向右金属性减弱,非金属性增强,
(1)Na的金属性最强,则与水反应最剧烈的金属单质是Na,故答案为:Na;
(2)金属性越强,对应碱的碱性越强,则最高价氧化物对应水化物碱性最强的是NaOH,故答案为:NaOH;
(3)最高价氧化物具有两性的是Al2O3,故答案为:Al2O3;
(4)最高价氧化物对应水化物酸性最强的是HClO4,故答案为:HClO4;
(5)非金属中Si的非金属性最弱,则气态氢化物最不稳定的是SiH4,故答案为:SiH4;
(6)用于自来水杀菌消毒的单质是Cl2,故答案为:Cl2;
(7)地壳中含量最高的金属元素是Al,故答案为:Al;
(8)不含化学键的物质是Ar,故答案为:Ar;
(9)具有相同电子排布的离子中原子序数大的离子半径小,阳离子中Al3+半径最小,阴离子中Cl-半径最小,故答案为:Al3+、Cl-.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素化合物的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
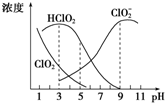 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数约为Ka=10-6 | |
| C. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(忽略Cl-),则混合溶液中有c(HClO2)+2c(H+)═c(ClO${\;}_{2}^{-}$)+2c(OH-) | |
| D. | 使用该漂白剂的最佳pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LC5H12含有的分子数为0.5NA | |
| B. | 21g乙烯与丁烯的混合气体中含有3NA个C-H键 | |
| C. | 1L0.1mol/LNH4NO3溶液中含有0.2NA个N | |
| D. | 光照下,1molCl2与足量CH4完全反应,生成NA个HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
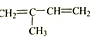 ⑤
⑤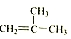
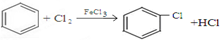 .
. .
. D.
D.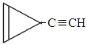 e.
e.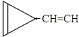 …
… 或
或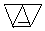 (只需答出一例的结构简式).
(只需答出一例的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 二氯乙烯的结构简式:CH2=C(Cl)2 | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若x=y,且a+b=14,则pH>7 | B. | 若10x=y,且a+b=13,则pH=7 | ||
| C. | 若ax=by,且a+b=14,则pH=7 | D. | 若x=10y,且a+b=14,则pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com