
科目:高中化学 来源:湖北省天门中学2008-2009学年高二下学期5月月考化学试题(A卷) 题型:022
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
Ⅰ:配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于________晶体.
Ⅱ:配合物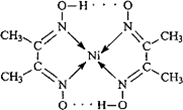 分子内的作用力有________(填编号).
分子内的作用力有________(填编号).
A.氢键
B.离子键
C.共价键
D.金属键
Ⅲ.氢气是新型清洁能源,但难储运.研究发现,合金可用来储藏氢气.镧(![]() )和镍(
)和镍(![]() )的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.
)的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.

(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收3个H2,这一过程用化学方程式表示为:________.
(2)下列关于该贮氢材料及氢气的说法中,正确的是________(填序号)
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
(3)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上.若把其中两个CO配位体换成NH3得到新的配合物,则以下物质中互为同分异构体的是________.(填字母编号,任填一组)(图中黑点为NH3,圆圈为CO,Ni略去)

查看答案和解析>>
科目:高中化学 来源:江苏省清江中学2008-2009学年第二学期高二化学第2次月考试卷 题型:022
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
Ⅰ:配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
________晶体.
Ⅱ:配合物 分子内的作用力有________(填编号).
分子内的作用力有________(填编号).
A.氢键
B.离子键
C.共价键
D.金属键
Ⅲ:氢气是新型清洁能源,但难储运.研究发现,合金可用来储藏氢气.镧(![]() )和镍(
)和镍(![]() )的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.
)的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.

(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收3个H2,这一过程用化学方程式表示为:________.
(2)下列关于该贮氢材料及氢气的说法中,正确的是________(填序号)
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
(3)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上.若把其中两个CO配位体换成NH3得到新的配合物,则以下物质中互为同分异构体的是________.(填字母编号,任填一组)(图中黑点为NH3,圆圈为CO,Ni略去)

查看答案和解析>>
科目:高中化学 来源: 题型:
已知常见物质A~J 可以发生如下图所示的转化,反应中部分生成物已略去。其中,构成单质A的原子最外层电子数是次外层的2倍;组成C的两种元素位于周期表的同一主族,其价电子构型可表示为ns2np4;B在固态时属于分子晶体,其晶胞结构如下图所示。
请回答下列问题:
(1)G单质对应的元素在周期表中位置是 ;
(2)写出E的两种用途是 ;
说明E的熔沸点明显高于B的主要原因是 ;
(3)反应①的化学方程式是 ;
反应④可能的离子方程式是 ;
反应⑤的离子方程式是 ;
(4)①~⑤的反应中属于氧化还原反应的是 。
查看答案和解析>>
科目:高中化学 来源:2014届山西省晋中市高二下学期期末考试化学试卷(解析版) 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
|
Y |
Y是地壳中含量最高的元素 |
|
Z |
Z的基态原子最外层电子排布式为3s23p1 |
|
W |
W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)

查看答案和解析>>
科目:高中化学 来源:2012届江苏省海门市高二下学期期末教学质量调研化学试题 题型:填空题
已知常见物质A~J 可以发生如下图所示的转化,反应中部分生成物已略去。其中,构成单质A的原子最外层电子数是次外层的2倍;组成C的两种元素位于周期表的同一主族,其价电子构型可表示为ns2np4;B在固态时属于分子晶体,其晶胞结构如下图所示。


请回答下列问题:
(1)G单质对应的元素在周期表中位置是 ;
(2)写出E的两种用途是 ;
说明E的熔沸点明显高于B的主要原因是 ;
(3)反应①的化学方程式是 ;
反应④可能的离子方程式是 ;
反应⑤的离子方程式是 ;
(4)①~⑤的反应中属于氧化还原反应的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com