


科目:高中化学 来源: 题型:
| A、3.5 | B、3.8 |
| C、2.5 | D、4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| B、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
| C、用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D、Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2及CaO2固体中阴、阳离子数之比均为2:1 |
| B、等质量的O2与O3中,氧原子的个数比为3:2 |
| C、分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2 |
| D、10mL 0.3mol?L-1NaCl与30mL0.1mol?L-1AlCl3溶液中Cl-物质的量浓度比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘酒是指单质碘的乙醇溶液 |
| B、84消毒液的有效成分是NaClO |
| C、生石灰用作食品抗氧剂 |
| D、小苏打是面包发酵粉的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
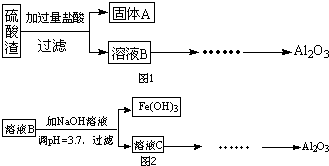 (1)写出溶液B的溶质是
(1)写出溶液B的溶质是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com