
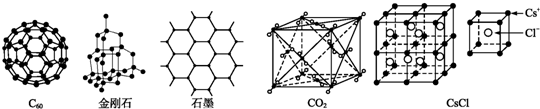
| 1 |
| 3 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| ||
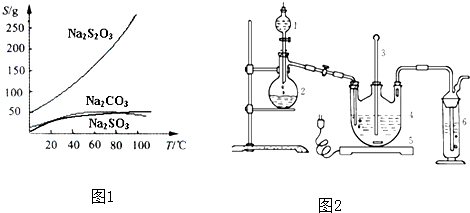
| ||
| 活性炭脱色 |
| 并保温 |
| 操作① |
| 蒸发浓缩 |
| 冷却晶体 |
| 操作② |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.6 mol/L |
| D、N的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
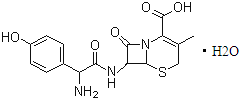
| A、头孢羟氨苄的化学式为C16H16N3O5S?H2O |
| B、1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol |
| C、在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2 |
| D、头孢羟氨苄在空气中能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、容器I、Ⅲ中平衡常数相同 |
| B、容器II、Ⅲ中正反应速率始终相同 |
| C、容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III |
| D、容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应一定是放热反应 |
| B、乙二醇和丙三醇都易溶于水和乙醇 |
| C、牺牲阳极的阴极保护法是利用了电解原理 |
| D、相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体单质中一定含有共价键 |
| B、由非金属元素组成的化合物一定是共价化合物 |
| C、含有离子键的晶体一定是离子晶体 |
| D、一定是在发生化学反应时,化学键才发生断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的最简式:C2H4 |
| B、CS2分子的结构式:S═C═S |
| C、醛基的结构简式:-CHO |
D、(羟基)的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉 淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
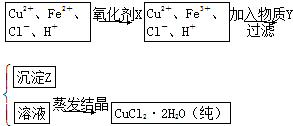
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com