
| A. | 工业上常利用油脂的碱性水解制取肥皂 | |
| B. | 雾、鸡蛋清水溶液、水与乙醇的混合液均具有丁达尔效应 | |
| C. | 蔬菜汁饼干易氧化变质:建议包装饼干时,加入一小包铁粉作抗氧化剂和吸水剂并密封 | |
| D. | 浸泡过高锰酸钾溶液的硅藻士可以吸收乙烯,所以可用此物保鲜水果 |
分析 A.油脂在碱性条件下水解生成高级脂肪酸盐和甘油;
B.只有胶体具有丁达尔效应;
C.铁具有还原性、吸水剂能吸收水分;
D.乙烯中含有碳碳双键能被酸性高锰酸钾溶液氧化.
解答 解:A.油脂在碱性条件下水解生成高级脂肪酸盐和甘油,高级脂肪酸钠是肥皂的主要成分,所以工业上常利用油脂的碱性水解制取肥皂,故A正确;
B.只有胶体具有丁达尔效应,乙醇和水的混合物是溶液,不能产生丁达尔效应,故B错误;
C.铁具有还原性、吸水剂能吸收水分,所以建议包装饼干时,加入一小包铁粉作抗氧化剂和吸水剂并密封,故C正确;
D.乙烯中含有碳碳双键能被酸性高锰酸钾溶液氧化,所以酸性高锰酸钾溶液能吸收乙烯,故D正确;
故选B.
点评 本题考查有机物结构和性质及氧化还原反应,为高频考点,明确元素化合物性质是解本题关键,会利用化学方法分析生产生活中的现象,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
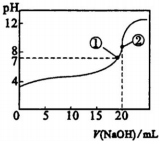
| A. | 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应 | |
| B. | 滴加至②时,c(OH-)-c(H+)=c(CH3COOH) | |
| C. | 滴定中,$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$逐渐减小 | |
| D. | 滴定中.c(CH3COOH)与c(CH3 C00-)之和保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
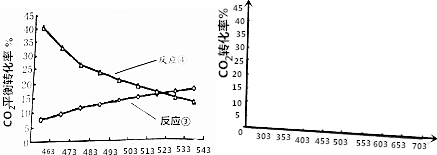
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 化学反应中的能量变化与反应物的总能量和生成物的总能量的相对大小无关 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
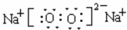 ,ED4的电子式是
,ED4的电子式是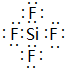 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA | |
| B. | 0.1mol${\;}_{35}^{81}$Br原子中含中子数为3.5NA | |
| C. | 6.0g SiO2晶体中含有的硅氧键数目为0.4NA | |
| D. | 7.8g过氧化钠中所含有的阴离子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com