
下列反应中,调节反应条件以后,反应产物不会改变的是( )
A.钠与氧气 B.NaOH溶液和Al2(SO4)3溶液
C.盐酸与铁粉 D.二氧化碳与氢氧化钠溶液
科目:高中化学 来源: 题型:
某工厂排放的废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是
A.Ag+、K+、NO3-、HCO3- B.K+、NH4+、NO3-、SO42-
C.Ag+、NH4+、Mg2+、HCO3- D.K+、Mg2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
铝硅合金(含Si 13.5%)在凝固时的收缩率很小,因而这种合金适合铸造。①铝、②硅、③铝硅合金、④铝粉四种物质,其中熔点最低的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
将6 mol A和5 mol B混合于4 L恒容密闭容器中,发生如下反应:3A(g)+B(g)  nC(g)+2D(g)
nC(g)+2D(g)
5 s后反应达到平衡状态,生成2 mol D,经测定以C表示的平均反应速率为0.1 mol·L-1·s-1。则下列结论中正确的是
A.5 s内以A表示的平均反应速率为0.15 mol·L-1·s-1
B.平衡时,B的浓度为1 mol·L-1
C.n值等于1
D.平衡时B的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = ▲ 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图3:

① N2(g)+O2(g) 2NO(g) ΔH= ▲ kJ·mol-1。
2NO(g) ΔH= ▲ kJ·mol-1。
② 尾气中空气不足时,NOx在催化转化器中被还原成N2。写出NO被CO还原的化学方程式 ▲ 。
③ 汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的ΔH>0,该设想能否实现? ▲ (填“能或不能”)。依据是 ▲ 。
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图4:

① 用离子方程式表示反应器中发生的反应 ▲ 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向硫酸亚铁、硫酸铁、硫酸铜的混合溶液中加入铁粉,充分反应后过滤,滤渣中有铜粉和少量铁粉。那么此时的溶液中( )
A.肯定有Fe2+,可能有Fe3+ B.肯定有Fe3+,可能有Cu2+
C.肯定有Fe2+,可能有Fe3+和Cu2+ D.只有Fe2+,没有Fe3+和Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
A~J分别表示中学化学中常见的物质,它们之间的相互转化关系如图所示(部分反应物、生成物没有列出)。已知:G为金属元素的固态氧化物(常温下);A、B、C、D、E、F六种物质中均含有同一种元素。(已知F为红褐色沉淀)
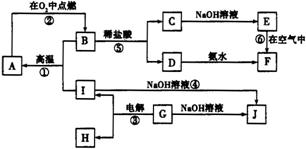
请填写下列空白:
(1)物质G的化学式是________。
(2)写出反应⑤的化学方程式________,写出反应④的离子方程式________。
(3)反应①~⑥中,不属于氧化还原反应的是________。(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式 (i) I2 (g)+ H2(g)  2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(ii) I2(S)+ H2(g) 2HI(g) ΔH=+26.48 kJ/mol. 下列判断正确的是
2HI(g) ΔH=+26.48 kJ/mol. 下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com