
A.分别和盐酸反应时,混合物消耗的盐酸量大
B.分别与足量盐酸反应时,混合物放出的CO2多
C.分别配制等体积的溶液,混合物的物质的量浓度大
D.分别配制等体积溶液,混合物的c(Na+)大
科目:高中化学 来源: 题型:
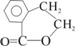
| △ |
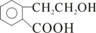
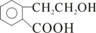




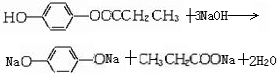
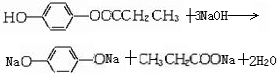
查看答案和解析>>
科目:高中化学 来源: 题型:
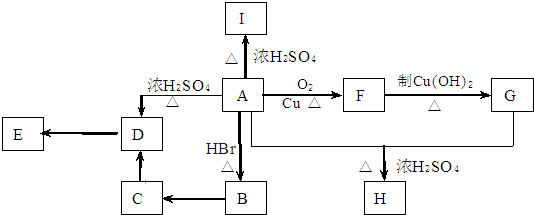
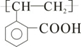
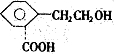
 A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如下图.已知:ROH+HX
A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如下图.已知:ROH+HX| △ |

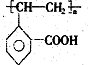
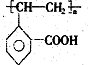
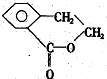




查看答案和解析>>
科目:高中化学 来源: 题型:
A.分别和盐酸反应时,混合物消耗的盐酸量大
B.分别与足量盐酸反应时,混合物放出的CO2多
C.分别配制等体积的溶液,混合物的物质的量浓度大
D.分别配制等体积溶液,混合物的c(Na+)大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市虹口区高三上学期期末考试(一模)化学试卷(解析版) 题型:计算题
胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4•5H2O。在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体。
(1)称取0.1000 g含有杂质的胆矾试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L硫酸滴定到终点,消耗硫酸10.08 mL,则试样中胆矾的质量分数为___________。
(已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;试样中的杂质不与酸、碱反应)
(2)将1.250 g 纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960 g。剩余固体中结晶水的质量分数为__________(保留三位小数)。
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体。现将9.600 g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416 g。计算最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比。
(4)无水硫酸铜受热分解成氧化铜之前,有一种黄色中间产物X出现,其化学式可以表示为CuaOb(SO4)c(a、b、c为整数)。将X放入水中,有不溶的蓝色沉淀Y生成(化学式为CuSO4·nCu(OH)2),同时还有2/3的硫酸根溶于水。若对Y进行加热脱水,将失去11.9%的质量。已知X和Y均可溶于稀硫酸。通过计算确定X和Y的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com