
| A、0.1mol?L-1 Na2S溶液中含有的Na+离子数为0.2NA |
| B、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C、标准状况下,22.4L以任意比例混合的氢气和氯气混合气中含有的原子总数为2NA |
| D、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
| V |
| 22.4 |
| V |
| 22.4 |
| 22.4L |
| 22.4L/mol |
| 0.4 |
| 3 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
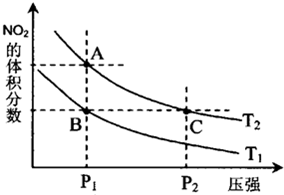 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、Ag+、NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即有气体产生 |
| C、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| D、NH4+、Al3+、SO42-、CH3COOH 要求:逐滴滴加NaOH溶液立刻有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30g SiO2含有NA个Si-O共价键 |
| B、1L 0.2mol?L-1 Al2(SO4)3溶液中的离子总数为NA |
| C、标准状况下,22.4L H2O所含原子个数大于3NA |
| D、含4mol HCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置Ⅰ可用于测定中和热 |
| B、装置Ⅱ装置放置一段时间后,饱和CuSO4溶液中不出现蓝色晶体 |
| C、装置Ⅲ中的石英坩埚可用于熔化氢氧化钠 |
| D、装置Ⅳ可用于吸收易溶于水的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1mol M最多可以与2mol Br2发生反应 |
| B、M在一定条件下可以发生消去反应、取代反应和加成反应 |
| C、一个M分子中最多有8个碳原子在同一平面上 |
| D、1mol M与足量的NaOH溶液反应,最多可以消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②④ | B、只有④ |
| C、只有②③④ | D、只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
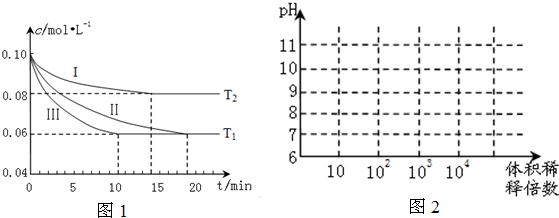
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com