
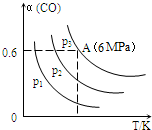
| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=$\frac{1}{64}$(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |
分析 A、反应是气体体积减小的反应,同温度下一氧化碳转化率越大说明压强越大;
B、反应达到平衡状态的标志是正逆反应速率相同,各组分含量保持不变,原则是变量不变;
C、A点一氧化碳转化率为6%,
3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g),
起始量(mol) 3 3 0 0
变化量(mol) 3×0.6 3×0.6 0.6 0.6
平衡量(mol) 1.2 1.2 0.6 0.6
根据v(H2)=$\frac{△c}{△t}$计算;
D、设起始量分别为1.5mol/L,依据转化率计算平衡物质的量浓度,KP是用平衡时各组分分压替代浓度的平衡常数,物质分压=混合气体总压强×该物质的物质的量分数,计算得到.
解答 解:A、3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g),可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,一氧化碳的转化率提高,因此压强关系是:p1<p2<p3;故A错误;
B、C-H键,H-H键的数量不同,断裂C-H键,H-H键速率相等,不能说明正逆反应速率相同,反应达到平衡状态,故B错误;
C、A点一氧化碳转化率为6%,
3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g),
起始量(mol) 3 3 0 0
变化量(mol) 3×0.6 3×0.6 0.6 0.6
平衡量(mol) 1.2 1.2 0.6 0.6
所以在0~10分钟内的平均速率v(H2)=$\frac{△c}{△t}$=$\frac{\frac{1.8}{2}}{10}$=0.09mol/(L•min),故C错误;
D、A点一氧化碳转化率为6%,则起始量分别为$\frac{3}{2}$=1.5mol/L,依据转化率计算平衡物质的量浓度
3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g),
起始量(mol/L) 1.5 1.5 0 0
变化量(mol/L) 1.5×0.6 1.5×0.6 0.3 0.3
平衡量(mol/L) 0.6 0.6 0.3 0.3
v(CO)%=v(H2)%=$\frac{0.6}{0.6+0.6+0.3+0.3}$=$\frac{1}{3}$
V(CH3OCH3)%=V(CO2)%=$\frac{0.3}{0.6+0.6+0.3+0.3}$=$\frac{1}{6}$
分压为p(CO)=p(H2)=$\frac{1}{3}$p(总)=$\frac{1}{3}$×6=2,p(CH3OCH3)=p(CO2)=$\frac{1}{6}$p(总)=$\frac{1}{6}$×6=1,Kp=$\frac{P(CH{\;}_{3}OCH{\;}_{3})P(CO{\;}_{2})}{P(CO){\;}^{3}P(H{\;}_{2}){\;}^{3}}$=$\frac{1×1}{2{\;}^{3}×2{\;}^{3}}$=$\frac{1}{64}$,故D正确;
故选:D.
点评 本题考查了化学平衡的分析判断,平衡计算的理解应用,影响平衡因素和平衡移动原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 两极材料 | Zn片、石墨 | Cu片、Ag | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | H2SO4溶液 | AgNO3溶液 | 蔗糖溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
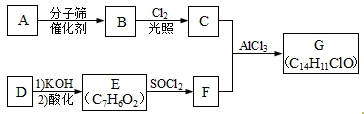
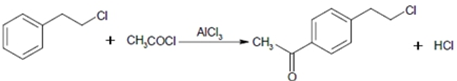
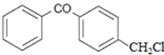 .
.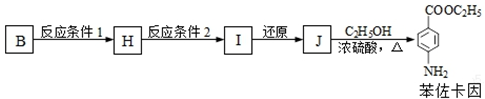
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
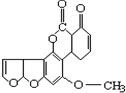
| A. | 1mol该化合物最多消耗H2和NaOH分别为6 mol和2 mol | |
| B. | 该化合物中含有三种官能团 | |
| C. | 该化合物中含有2个苯环结构 | |
| D. | 该化合物可以和1mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
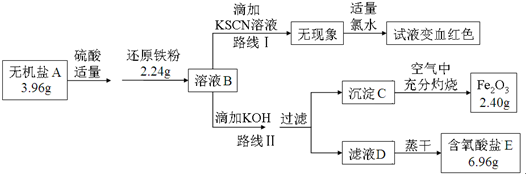
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com