
据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个 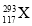 ,1个
,1个 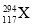 。下列关于
。下列关于 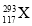 和
和 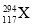 的说法不正确的是( )
的说法不正确的是( )
A.是两种核素 B.互为同位素 C.中子数分别为176和177 D.电子数相差1
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为 。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是
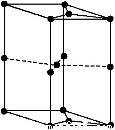
(6)如图为石墨晶胞结构示意图,该晶胞中含有碳原子的个数为
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:填空题
水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH=+131 kJ·mol-1
CO (g)+H2 (g) ΔH=+131 kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
Ⅰ | 0.06 | 0.60 | 0.10 | v正=v逆 |
Ⅱ | 0.06 | 0.50 | 0.40 | ① |
Ⅲ | 0.12 | 0.40 | 0.80 | v正<v逆 |
Ⅳ | 0.12 | 0.30 | ② | v正=v逆 |
① ,② 。
在T温度下该反应的化学平衡常数为 。
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)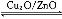 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
下列有关物质的性质或结构的说法正确的是( )
A.第二周期元素最高价与其原子最外层电子数相等
B.Na的原子半径比Cl的大,但Na+的半径比Cl-的小
C.Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱
D.Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题6原子结构化学键练习卷(解析版) 题型:选择题
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于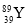 的说法不正确的是( )
的说法不正确的是( )
A.属于金属元素 B.质子数与中子数之差为50
C.原子的核外电子数是39 D.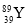 和
和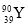 是两种不同的核素
是两种不同的核素
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:选择题
已知①2C(s)+O2(g) 2CO(g) ΔH=-221.0 kJ·mol-1
2CO(g) ΔH=-221.0 kJ·mol-1
②2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
则反应C(s)+H2O(g) CO(g)+H2(g)的ΔH为( )
CO(g)+H2(g)的ΔH为( )
A.+131.3 kJ·mol-1B.-131.3 kJ·mol-1 C.-352.3 kJ·mol-1D.+262.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:选择题
下列物质间的反应,其能量变化符合如图的是( )
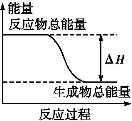
A.铁与硫粉在加热条件下的反应
B.灼热的碳与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题3离子反应练习卷(解析版) 题型:选择题
在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是( )
A.Fe3+B.Fe2+C.Al3+D.NH4+
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题21化学实验基础练习卷(解析版) 题型:填空题
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流等等。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 (可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水,有刺激性气味,对人的呼吸系统有损伤,可与碱发生作用。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
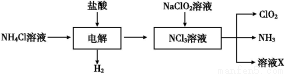
(1)写出电解时发生反应的化学方程式 ;
(2)除去ClO2中的NH3可选用的试剂是 (填序号);
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2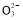
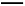 2I-+S4
2I-+S4 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
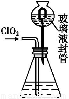
①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com