
���� ��1���ٴ�SiHCl3��������Ӧ���ɹ���Ȼ��⣻
������ԭ�Ӹ����غ��ϻ��ϼ۱仯д������ʽ��
�۸����£�������������ϣ���������ը��
�ܸ��ݷ�Ӧ��������״̬�������ı仯д���Ȼ�ѧ����ʽ��
��2��A��ԭ�Ӿ����۵�ߣ����£�
B��������������۹��ԣ�
C�����۵�ϸߣ�
D�����������Ӧ��
��3��SiO32-��NH4+����˫ˮ�ⷴӦ���ɰ�ɫ��״��������Ͱ�ˮ��
��� �⣺��1���ٴ�SiHCl3��������Ӧ���ɹ���Ȼ��⣬����ʽΪ��SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl��
�ʴ�Ϊ��SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl��
��SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��HCl����������ѧ����ʽΪ��SiHCl3+3H2O=H2SiO3��+H2��+3HCl����
�ʴ�Ϊ��SiHCl3+3H2O=H2SiO3��+H2��+3HCl����
��H2��ԭSiHCl3����������O2�������£�������������ϣ���������ը��
�ʴ�Ϊ�������£�H2��O2������ը��
��������������ˮ������״̬������̬��ȼ�պ�ų����������ԡ�H��0��2g���������ʵ�����1mol��1mol����ȼ�պ�ų�241.8kJ��������2mol����ȼ�պ�ų�483.6 kJ������������������������ȫ��Ӧ����ˮ�������Ȼ�ѧ����ʽΪ��2H2��g��+O2��g���T2H2O��g����H=-483.6 kJ/mol��
�ʴ�Ϊ��2H2��g��+O2��g���T2H2O��g����H=-483.6 kJ/mol��
��2��A��SiC��Si3N4��Ϊԭ�Ӿ��壬�۵�ߣ������ȶ�����A��ȷ��
B��������������۹��ԣ������ڹ��ά����B��ȷ��
C����ͨ��������Ҫ�ɷ�ΪNa2SiO3��CaSiO3��������ʯӢɰ��SiO2����ʯ��ʯ��CaCO3���ʹ��Na2CO3��Ϊ��Ҫԭ�Ϸ�Ӧ�Ƴɵģ��۵�ܸߣ���C��ȷ��
D�������£�Siֻ����Ψһһ����HF��Ӧ������HCl��Ӧ����D����
�ʴ�Ϊ��ABC��
��3��SiO32-��NH4+����˫ˮ�ⷴӦ���ɰ�ɫ��״������SiO32-��NH4+����˫ˮ�ⷴӦ������ʽΪ��SiO32-+2NH4++2H2O�T2NH3•H2O+H2SiO3����
�ʴ�Ϊ�������ɰ�ɫ��״��������SiO32-+2NH4++2H2O�T2NH3•H2O+H2SiO3����
���� �����ۺϿ����Ͷ�����������ʣ�Ϊ��Ƶ���㣬�����ڻ�ѧ�빤ҵ�����Ŀ��飬��Ŀ�Ѷ��еȣ�ע����ػ���֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʳ��ˮ | B�� | �������� | C�� | ���ȵ�ͭ�� | D�� | Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
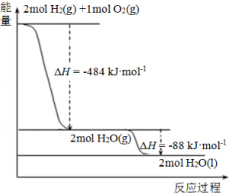
| A�� | 926 kJ•mol-1 | B�� | 485kJ•mol-1 | C�� | 463 kJ•mol-1 | D�� | 221 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ����ܶȣ�20�棩 | �۵� | �е� | �ܽ��� | |
| A | 0.7137 | -116.6��C | 34.5��C | ������ˮ |
| B | 0.7893 | -117.3��C | 78.5��C | ��ˮ������Ȼ��� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
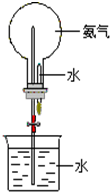 ��֪�������Ȼ������嶼�Ǽ�������ˮ�����壬�ڱ�״����1��ˮ��������ܽ�500�����Ȼ������壬����700���İ�����
��֪�������Ȼ������嶼�Ǽ�������ˮ�����壬�ڱ�״����1��ˮ��������ܽ�500�����Ȼ������壬����700���İ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú����������Һ�����������仯���ɱ�Ϊ�����Դ | |
| B�� | ��Ȼ���к��д���������̬�Ĺ裬�����Ĺ辧����������������оƬ | |
| C�� | ����β���Ĵ����ŷ�Ӱ���˿����������������PM2.5ֵ���ߵ�ԭ��֮һ | |
| D�� | ������������������ˮ��ɱ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ƿ�ں�����ˮ | B�� | ���������к�������̼���� | ||
| C�� | ���Ӷ��� | D�� | �ܽ���������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com