
(1)25。C时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010.请回答下列问题:
①HA是__________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________(填字母)。
A. c(H+)/c(HA) B. c(HA) /( A-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(2)已知:CH4+H2O=CO(g)+3H2(g)  H=+206.2kJ·mol-1
H=+206.2kJ·mol-1
CH4+CO 2=2CO(g)+2H2(g)  H=-247.4kJ·mol-1
H=-247.4kJ·mol-1
CH4(g)与H2O(g)反应生成CO 2(g)和H2(g)的热化学方程式为__________.
(3)下图是利用甲烷燃料电池电解50 mL 2mol/L的氯化铜溶液的装置示意图:
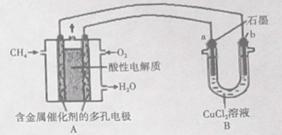
请回答:
①甲烷燃料电池的负极反应式为_______________.
②当线路中有0.6mol电子通过时,B中阳极产物的质量为___________g.
知识点】弱电解质的电离 盖斯定律 电化学 F3 F4 H1
【答案解析】(1)①弱电解质(2分) ②AD(3分)(只选一个且正确给1分,出现错误选项不得分)
(2))CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=+659.8 kJ·mol-1(3分)
(3)CH4-8e-+2H2O=CO2+8H+(3分) 10.3(3分)
解析:(1)①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸,c(H+)/c(OH-)=1012而溶液中c(H+)/c(OH-)=1010所以该酸是弱酸,弱酸中存在电离平衡。 ②A.加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢离子浓度减小的量小于酸分子减小的量,所以c(H+)/c(HA)增大,故A正确;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以c(HA) /( A-)减小,故B错误;
C.温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D正确;
(2)利用盖斯定律,用已知的第一个热化学方程式乘以2减去第二个热化学方程式得:CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=+659.8 kJ·mol-1
(3)①根据负极发生失电子的反应,以及电解质溶液显酸性得:CH4-8e-+2H2O=CO2+8H+
②甲烷燃料电池电解50 mL 2mol/L的氯化铜溶液,溶液中n(Cl-)=0.2mol,电解一段时间后,阳极电极反应:2Cl--2e-=Cl2↑,0.2mol氯离子失电子0.2mol生成氯气0.1mol,所以氢氧根离子失电子0.4mol,4OH--4e-=2H2O+O2↑,转移0.4mol电子生成氧气0.1mol,共生成气体的质量0.1×71+0.1×32=10.3(克)
【思路点拨】本题考查了电解质溶液、原电池电解池原理的分析应用,电极反应的书写和电子守恒的计算是解题关键,题目难度中等。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
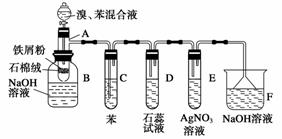
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_________________________________________。
(2)试管C中苯的作用是__________________。反应开始后,观察D和E两试管,看到的现象为________________________________________________________________________。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸作用的仪器有________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将有机物完全燃烧,生成CO2和H2O。将12 g该有机物完全燃烧后的产物通过浓H2SO4,浓H2SO4增重14.4 g,再通过碱石灰,碱石灰增重26.4 g。该有机物分子式为( )
A.C4H10 B.C2H6O
C.C3H8O D.C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是锌、铜和稀硫酸形成的原电池,下列叙述不合理的是
A.溶液中H+向Zn电极移动
B.外电路中电流方向为:Cu→Zn
C.负极上的电极反应:Zn-2e-===Zn2+
D.有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
2010年4月中旬全球核安全峰会在华盛顿举行,发展核电、制裁核武器发展是会议主题,各式各样电池的发展是化学对人类的一项重大贡献,下列有关电池的叙述正确的是
A.手机上用的锂离子电池属于一次电池
B.锌锰干电池中,锌电极是负极
C.氢氧燃料电池工作时氢气在负极被还原
D.太阳能电池的主要材料为二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下列物质说法不正确的是( )
A.Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱
B.相同温度下,等物质的量浓度的Na2CO3和NaHCO3溶液pH:Na2CO3 > NaHCO3
C.将两支蘸有浓盐酸和浓氨水的玻璃棒相互靠近有大量白烟产生
D.HCl、NH3、CO2都极易溶于水,都可用水作吸收剂做喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
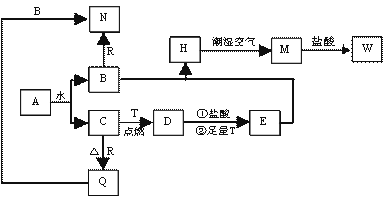
(1)写出下列物质的化学式:
A: D: R: 。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式: ;
向N中通足量CO2时反应的离子方程式: ;
D与盐酸反应的离子方程式: 。
(3)简述检验气体C的方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在800 K时,反应:CO(g)+H2O(g)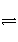
 H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com