
【题目】已知:A(g)+ 2B(g)![]() C(g)+2D(s),经测定,在不同温度下该反应的平衡常数如下:
C(g)+2D(s),经测定,在不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 30 | 15.78 | 12.5 |
(1)该反应为__________反应(填“吸热”“放热”).平衡常数K的表达式为K=____________
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
①容器中压强不变 ②混合气体中c(A)不变 ③2v正(B)=v逆(A) ④ 容器内温度不变 ⑤容器中混合气体的密度不变 ⑥ 平均摩尔质量不变 ⑦c(A):c(b):c(c)=1:2:1
A.除③以外 B.④⑤⑦ C.①②④⑤⑥ D.④⑤⑥⑦
(3)欲提高B的转化率并加快化学反应速率,下列措施可行的是_____________。(填字母)
a.在恒压下中再充入He b.向恒容体积再充入A
c.改变反应的催化剂 d.升高温度
(4)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(A)=0.4 mol·L-1、c(B)=0.4 mol·L-1、c(C)=0.8 mol·L-1, 则此时的温度为___________;
(5)某温度下,在体积固定的1L的密闭容器中将2 mol A和2 mol B混合,测得不同时刻的压强关系如下:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
总压强p/MPa | 20 | 18 | 16.5 | 15 | 12.5 | 12.5 |
①计算反应到2h时v(A)=__________
②计算平衡时B的转化率为 __________,该温度下反应的平衡常数值________。
③由总压强p和起始压强p0表示反应体系的总物质的量n(总)和生成物C的物质的量n(C),则 n(总 )=________mol,n(C)=___________mol,反应物A的转化率α(A)的表达式为_______________________。
【答案】放热 ![]() C b 350℃ 0.175mol/(L·h)或0.0029mol/(L·min) 75% 2.4或
C b 350℃ 0.175mol/(L·h)或0.0029mol/(L·min) 75% 2.4或![]() 4P/P0 2-
4P/P0 2-![]() (1-
(1-![]() )×100%
)×100%
【解析】
(1)由题中数据可知,升高温度平衡常数减小,该反应为放热反应,根据平衡常数定义书写该反应的平衡常数表达式;
(2)达到平衡状态时正逆反应速率相等,各物质的浓度保持不变,以此判断;
(3)根据化学反应速率和化学平衡的影响因素进行判断;
(4)利用题中数据计算平衡常数,与表中数据对比判断反应温度;
(5)根据三段式结合气体压强比等于物质的量之比进行计算。
(1)由题中数据可知,升高温度平衡常数减小,说明升高温度平衡逆向移动,则该反应为放热反应,生成物D为固体,所以平衡常数表达式为![]() ;
;
故答案为:![]() ;
;
(2)①该反应为反应前后气体的物质的量不等的可逆反应,容器中压强不变,说明正逆反应速率相等,反应达到平衡状态,故①选;
②混合气体中c(A)不变,说明正逆反应速率相等,反应达到平衡状态,故②选;
③反应达到平衡状态时,用不同物质表示的正逆反应速率之比等于化学计量数之比,即v正(B)=2v逆(A),则2v正(B)=v逆(A) 不能说明反应达到平衡状态,故③不选;
④该反应在恒容绝热的密闭容器中进行,容器内温度不变,说明反应达到平衡状态,故④选;
⑤生成物D为固体,在恒容的密闭容器中,容器的体积不变,但气体的质量为变量,所以容器中混合气体的密度为变量,混合气体的密度不变,说明反应达到平衡状态,故⑤选;
⑥该反应为反应前后气体的物质的量不等的可逆反应,生成物D为固体,气体的质量为变量,所以平均摩尔质量为变量,平均摩尔质量不变,说明反应达到平衡状态,故⑥选;
⑦c(A):c(b):c(c)=1:2:1,不能说明各物质的浓度不变,不能说明反应达到平衡状态,故⑦不选;
答案选:C;
(3)a.在恒压下中再充入He,容器的体积增大,各物质的浓度减小,化学反应速率减小,故a不选;
b.向恒容体积再充入A,A的物质的量浓度增大,化学反应速率增大且平衡向正向移动,B的转化率增大,故b选;
c.改变反应的催化剂,可以改变化学反应速率,但平衡不移动,B的转化率不变,故c不选;
d.该反应为放热反应,升高温度可以加快化学反应速率,但平衡逆向移动,B的转化率减小,故d不选;
(4)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(A)=0.4 mol·L-1、c(B)=0.4 mol·L-1、c(C)=0.8 mol·L-1,平衡常数K=![]() =12.5,由表中数据可知,此时的温度为350℃,
=12.5,由表中数据可知,此时的温度为350℃,
故答案为:350℃;
(5)①某温度下,在体积固定的1L的密闭容器中将2 mol A和2 mol B混合,气体的压强比等于气体的物质的量之比,根据三段式有:
A(g)+ 2B(g)![]() C(g)+2D(s)
C(g)+2D(s)
起始(mol)2 2 0
转化(mol)x 2x x
2h(mol) 2-x 2-2x x
则2h时:![]() =
=![]() ,解得x=0.35mol,所以反应到2h时v(A)=
,解得x=0.35mol,所以反应到2h时v(A)=![]() =0.175mol/(L
=0.175mol/(L![]() h),
h),
故答案为:0.175mol/(L![]() h);
h);
②由表中数据可知,反应达到平衡时,容器内压强为12.5,与上述同样方法计算,得出达到平衡时A转化了0.75mol、B转化了1.5mol、C生成了0.75mol,
则平衡时B的转化率为 ![]() ×100%=75%,
×100%=75%,
该温度下反应的平衡常数K=![]() =2.4,
=2.4,
故答案为:75%;2.4;
③依据压强比等于物质的量之比得![]() =
=![]() ,n(总)= 4P/P0mol;
,n(总)= 4P/P0mol;
结合三行式![]() =
=![]() ,解得n(C)= (2-
,解得n(C)= (2-![]() )mol;
)mol;
转化A的物质的量为(2-![]() )mol,反应物A的转化率α(A)=
)mol,反应物A的转化率α(A)=![]() ×100%=(1-
×100%=(1-![]() )×100%,
)×100%,
故答案为:(1-![]() )×100%。
)×100%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有四种元素基态原子电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5.则下列有关比较中正确的是
A. 单电子数:③>① B. 原子半径:④>③
C. 电负性:②>① D. 最高正化合价:④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0molA,反应A(g)===B(g)+C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A. 反应在前50s的平均速率v(B)=0.0032mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(B)=0.11mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,反应达到平衡前v正<v逆
D. 相同温度下,起始时向容器中充入2.0mol B和2.0mol C,达到平衡时,B的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在周期表中的相对位置如图所示,其中Q原子的质子数是其最外层电子数的三倍。下列说法正确的是

A. 原子半径:R>T
B. 氧化物对应水化物的酸性:W>Q
C. 最简单气态氢化物的热稳定性:R>Q
D. Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,下列说法正确的是

A. 实验①可观察到红色喷泉
B. 实验②可收集到少量氨气
C. 实验③中逐滴滴加稀盐酸时,试管中立即产生大量气泡
D. 实验④中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素,原子序数依次增大,A 原子的最外层上有4个电子;B的阴离子和 C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为_____。D在周期表中位置_____。
(2)A、D两元素形成的化合物属_____(填“离子”或“共价”)化合物。
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:_____。
(4)B原子与氢原子形成的粒子中,与NH3具有相同电子数的阴离子为_____(填化学式),阳离子为_____(填化学式),其中阴离子的电子式为_____。
(5)写出B与氯元素和氢元素形成的氯水中含有的具有漂白性物质的结构式 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:

下列说法正确的是( )
A.250 ℃,前2 min, Si3N4 的平均反应速率为0.02 mol·L-1·min-1
B.反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C.达到平衡前,300 ℃条件的反应速率比250 ℃快; 平衡后,300 ℃比250 ℃慢
D.反应达到平衡时, 两种条件下反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某盐的成分, 做了如下实验:
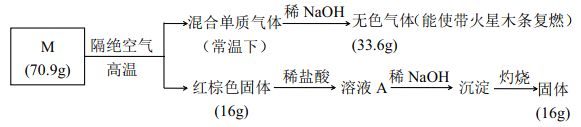
请回答:
(1)盐 M 的化学式是_________;
(2)被 NaOH 吸收的气体的电子式____________;
(3)向溶液 A 中通入H2S 气体, 有淡黄色沉淀产生, 写出反应的离子方程式________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种高效安全消毒剂,常温下
是一种高效安全消毒剂,常温下![]() 为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备
为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备![]() 水溶液并检验其性质。
水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。

在圆底烧瓶中先放入![]() 固体和
固体和![]() ,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
(1)装置A用水浴加热的优点是_________;装置A中水浴温度不低于60℃,其原因是_______________。
(2)装置A中反应生成![]() 及
及![]() 等产物的化学方程式为_____________________;
等产物的化学方程式为_____________________;
(3)装置B的水中需放入冰块的目的是__________________;已知![]() 缓慢水解生成的含氯化合物只有
缓慢水解生成的含氯化合物只有![]() 和
和![]() ,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的
,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的![]() 溶液吸收尾气中的
溶液吸收尾气中的![]() ,生成物质的量之比为的1:1的两种盐,一种为
,生成物质的量之比为的1:1的两种盐,一种为![]() ,另一种为_________________。
,另一种为_________________。
Ⅱ.![]() 的含量测定
的含量测定
步骤1:量取![]() 溶液
溶液![]() ,稀释成
,稀释成![]() 试样;量取
试样;量取![]() 试样加入到锥形瓶中;
试样加入到锥形瓶中;
步骤2:调节试样的![]() ,加入足量的
,加入足量的![]() 晶体,振荡后,静置片刻;
晶体,振荡后,静置片刻;
步骤3:加入指示剂,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。
。
(4)已知:![]() ,
,![]() ,原
,原![]() 溶液的浓度为_____
溶液的浓度为_____![]() (用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
(用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
Ⅲ.设计实验验证![]() 的氧化性
的氧化性
(5)取适量![]() 水溶液加入
水溶液加入![]() 溶液中,振荡,得无色溶液。欲检验
溶液中,振荡,得无色溶液。欲检验![]() 的氧化产物,还需要用到的试剂是____________。
的氧化产物,还需要用到的试剂是____________。
(6)证明![]() 的氧化性比
的氧化性比![]() 强的方案是__________________________________。
强的方案是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com