
(1)漂白衣料时常采用如下操作:①将待漂白的衣物浸泡在漂白粉的溶液中,取出后露置在空气中。②将衣物置于极稀的盐酸中漂洗。③最后将衣物置于Na2S2O3溶液中浸洗,取出晾干完成漂白作用。写出上述①②过程中涉及的化学反应方程式。
(2)在厨房里若用漂白粉消毒餐具时,如果要求在短时间内其消毒效果最好,可加入少量的( )
A.食盐 B.食醋 C.纯碱 D.小苏打
解析:(1)本题属理论联系实际题。解决此题必须清楚:
①Ca(ClO)2·2CaCl2·Ca(OH)2·2H2O在溶液中的电离,相当于Ca(ClO)2、CaCl2和Ca(OH)2三种化合物的电离;
②漂白粉的有效成分是Ca(ClO)2;
③漂白粉的漂白原理:只有次氯酸钙转化成次氯酸时,漂白粉才能产生真正的漂白作用;
④工业上常用Na2S2O3溶液消除卤素。
(2)次氯酸钙遇酸能较快地转化成次氯酸,从而加速漂白作用,食醋中含有醋酸。
答案:(1)①中Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO和2HClO![]() 2HCl+O2↑
2HCl+O2↑
②中稀盐酸主要是除去衣物上粘附的碳酸钙,CaCO3+2HCl====CaCl2+H2O+CO2↑
(2)B


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
|
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中, 加入适量的1mol/L盐酸溶解后,将产生的气体通入足量的澄清石灰水中 加入适量的1mol/L盐酸溶解后,将产生的气体通入足量的澄清石灰水中 |
(1)若澄清石灰水未见浑浊,则假设1成立 (2)若澄清石灰水变浑浊,则假设2或3成立 (1)若澄清石灰水未见浑浊,则假设1成立 (2)若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 向步骤①反应后的试管滴入1~2滴品红溶液,振荡 向步骤①反应后的试管滴入1~2滴品红溶液,振荡 |
(1)若品红褪色,固体中存在 Ca(ClO)2,假设3成立;(2)若品红不褪色,则固体中不存在 Ca(ClO)2,假设2成立; (1)若品红褪色,固体中存在 Ca(ClO)2,假设3成立;(2)若品红不褪色,则固体中不存在 Ca(ClO)2,假设2成立; |
| ③ | 此空不填写 此空不填写 |
此空不填写 此空不填写 |
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省五校协作体高三上学期期初联考化学试卷(带解析) 题型:实验题
(13分)氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。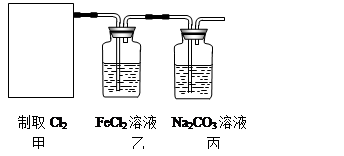
①在该实验中,甲部分的装置是 (填字母)。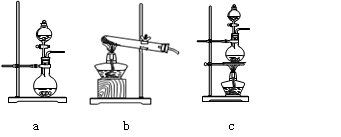
②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
④该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省揭阳市高三上学期期末考试理综化学试卷(解析版) 题型:实验题
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:________________ __,漂白粉的有效成分为 。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 |
|
|
步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入
|
现象:
结论: |
|
步骤3:取滤液分装A、B两支试管。向A试管,
|
现象:溶液先变红色,然后褪色。 结论:
|
|
步骤4:向B试管,
|
现象:产生白色沉淀。 结论: |
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为_____________ _。(只列算式,不做运算,已知:Mr[Ca(ClO)2]=143 ;Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高一11月月考化学试卷(解析版) 题型:选择题
用4种溶液进行实验,下表中“操作及现象”与“溶液”不符的是
|
选项 |
操作及现象 |
溶液 |
|
A |
通入SO2,溶液不变浑浊,再加氯水,变浑浊 |
BaCl2溶液 |
|
B |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
Ca(ClO)2溶液 |
|
C |
通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
Ca(OH)2溶液 |
|
D |
通入NH4HCO3受热分解产生的气体,溶液变浑浊,继续通入该气体,浑浊消失 |
Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省岳阳市高三第一次质量检测化学试卷(解析版) 题型:选择题
进行下列实验,由实验现象得出的结论错误的是( )
|
选项 |
操作及现象 |
溶液可能是 |
|
A |
通入CO2,溶液变浑浊。再升高至70℃,溶液变澄清。 |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
Na2SiO3溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com