
| A. | Ag++Cl-→AgCl↓ | B. | Ag++Br-→AgBr↓ | ||
| C. | Ag++CO32-→AgCO3↓ | D. | Ag2CO3+2H+→2Ag++CO2↑+H2O |
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:实验题
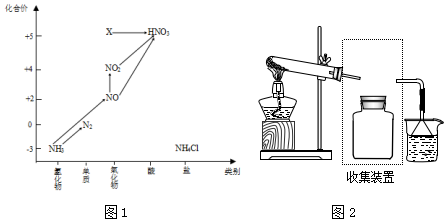
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 酸性KMnO4溶液中加入H2O2溶液,产生气体 | KMnO4催化H2O2分解产生O2 |
| B | 光亮的铁片放在浓硝酸中浸泡一段时间后取出,用蒸馏水中冲洗后放入CuSO4溶液,无明显现象 | 铁片在浓硝酸中发生钝化,表面生成致密的氧化膜 |
| C | 向废FeCl3蚀刻液X中加入少量铁粉,振荡,得到澄清透明的溶液 | X中一定不含Cu2+ |
| D | 分别在盛有相同浓度ZnSO4、CuSO4溶液的试管中通入足量H2S气体,后者有黑色沉淀 | KSP(ZnS)<KSP(CuS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2+CO2=CaCO3↓+H2O | B. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO | ||
| C. | 2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ | D. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比c(X):c(Y):c(Z)=2:3:4 | B. | 消耗2molX,同时消耗4molZ | ||
| C. | 混合气体的密度保持不变 | D. | 反应放出akJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,8.0gSO3体积为2.24L | |
| B. | 物质的量为1molSO2、CO2的混合物所含氧原子数为2NA | |
| C. | 0.1molFeCl3溶液中含有的Fe3+数为0.1NA | |
| D. | 0.5mol镁在空气中完全燃烧所需要的氧气的物质的量为0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 现象 | 由现象所得结论 |
| A | 将Cl2通入品红溶液 | 品红褪色 | Cl2具有漂白性 |
| B | 分别测量饱和NaCO3、饱和NaHCO3溶液的pH | pH值:碳酸钠>碳酸氢钠 | 水解能力:CO32->HCO3- |
| C | 将CO2通入CaCl2的溶液中 | 无明显现象 | 酸性:盐酸>碳酸 |
| D | 观察铁块、铝箔在潮湿空气中的腐蚀情况 | 铁块生锈,而铝箔几乎无变化 | 在潮湿空气中铁比铝要活泼 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com