
| A、向稀氨水中通入过量的CO2:2NH3?H2O+CO2═2NH4++H2O+CO32- |
| B、在30mL 1mol?L-1的Na2S03溶液中通入224 mL标准状况下的Cl2:3SO32-+Cl2+H2O=SO42-+2HSO32-+2Cl- |
| C、某钾盐(K2A)的水溶液显碱性,其原因是:A2-+2H2O?H2A+20H- |
| D、在Ba(HCO3)2溶液中逐滴滴入NaHSO4溶液至Ba2+恰好完全沉淀:Ba2++2HCO3-+2H++SO42-═BaSO4↓+2CO2↑+2H2O |
| 0.224L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、原电池的负极是镁 |
| B、负极的电极反应式是Mg-2e=Mg2+ |
| C、原电池的负极是铝 |
| D、正极的电极反应式是2H++2e=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2+Cl2
| ||||
| B、Na2O+H2O=2NaOH | ||||
C、2KClO3
| ||||
| D、Cu+2FeCl3=CuCl2+2FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应体系的总压恒定 |
| B、B的浓度不变 |
| C、C(A):C(B)=1:3 |
| D、2V(B)正=3V(C)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka=4.3×10-7 Ka=5.6×10-11 |
| A、相同浓度溶液的酸性:HCOOH>H2CO3>HCN |
| B、2CN-+H2O+CO2→2HCN+CO32- |
| C、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| D、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸保存在无色玻璃试剂瓶中 |
| B、少量的钠保存在煤油中 |
| C、新制的氯水通常保存在棕色玻璃试剂瓶中 |
| D、漂白粉密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3v正(N2 )=v正(H2 ) |
| B、v正(N2 )=v逆(NH3) |
| C、2v正(H2 )=3v逆(NH3) |
| D、v正(N2 )=3v逆(H2 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
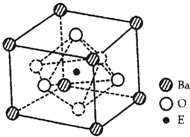 已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com