
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )
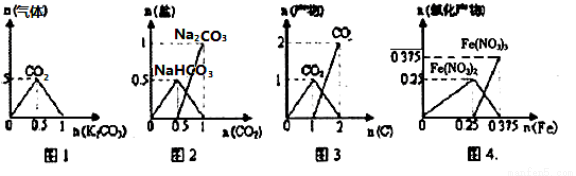
A.图l:n(HCl)=lmol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1 mol,CO2逐步通人到NaOH溶液中反应生成的盐
C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物
D.图4:n(HNO3)=lmol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
科目:高中化学 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:填空题
【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。

①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源:2017届北京市央民族大学附高三上9.12周练化学卷(解析版) 题型:选择题
下列叙述正确的是( )
A.直径介于1nm~100nm之间的微粒称为胶体
B.胶体粒子可以透过滤纸
C.氯化钠在通电的条件下电离
D.用含1molFeCl3溶液可制得6.02×1023个Fe(OH)3胶体粒子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:填空题
Ⅰ.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。
②CrO2-是一种酸根离子,则Fe(CrO2)2属于__ _(填“酸”、“碱”、“盐”或“氧化物”)。
③明胶的水溶液和K2SO4溶液共同具备的性质是 。
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸
Ⅱ.Cr是一种银白色金属,化 学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
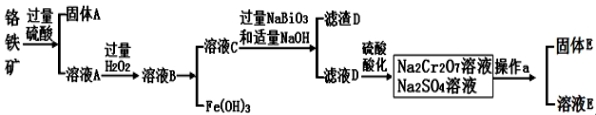
查阅资料:
常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,用硫酸而不选用盐酸,可能的原因是 。
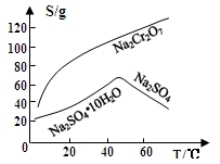
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;(用离子方程式表示)
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含有I—浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。
主要步骤如是:
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为:N2H4+2I2=4I-+N2+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥将⑤反应后的溶 液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2=Na2S4O6+2NaI
液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2=Na2S4O6+2NaI
经过上述放大后,溶液中I-浓度放大为原溶液中I-浓度的(设前后溶液体积相等)( )
A.2倍 B.4倍 C.36倍 D.16倍
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
在学习中,我们经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是( )
A | 向FeCl2溶液中滴入氯水 | 向FeCl2溶液中滴入碘水 |
B | 向澄清石灰水中通入少量CO2气体 | 向澄清石灰水中通入少量SO2气体 |
C | 向Na2CO3溶液中滴入稀HNO3 | 向Na2SO3溶液中滴入稀HNO3 |
D | CO2通入漂白粉溶液中 | SO2通入漂白粉溶液中 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
A.两溶液混合,AgCl和AgI都沉淀
B.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主
C.向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大
D.若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com