
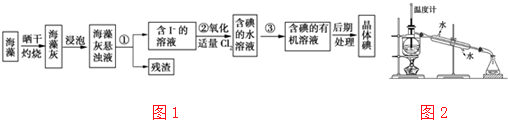
分析 (1)分离固体与液体混合物应用过滤;依据碘单质易溶于有机溶剂,结合萃取分液操作解答;氯气具有氧化性,能够氧化碘离子生成单质碘;
(2)选用的萃取剂的原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂;
(3)依据蒸馏装置图分析判断,根据实验原理选择合适的仪器;
(4)蒸馏实验中蒸馏烧瓶加热应垫石棉网;温度计测定温度为蒸汽的温度;为达到最佳冷凝效果冷凝水与蒸汽流向相反,据此解答;
(5)有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管,所以实验中使用水浴.碘是固态,因此最后晶体碘聚集在蒸馏烧瓶中.
解答 解:(1)依据流程图可知:操作①前为海带灰悬浊液,操作①后为含碘离子的溶液,可知操作①为分离固体与液体的操作为过滤;
依据流程图可知:操作③前为含碘水溶液,操作③后含碘的有机溶剂,所以操作③为萃取分液;
氯气具有氧化性,能够氧化碘离子生成单质碘,离子方程式:Cl2+2I-═2Cl-+I2;
故答案为:过滤;萃取分液;Cl2+2I-═2Cl-+I2;
(2)提取碘的过程中为萃取,萃取剂选择原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,
A.乙醇与水互溶,不能萃取碘水中的碘,故A不选;
B.四氯化碳与水互不相溶,碘在四氯化碳中溶解度远远大于水中,故B选;
C.苯与水互不相溶,碘在苯中溶解度远远大于水中,故C选;
D.乙酸能够与水互溶,不能用乙酸萃取碘水中的碘,故D不选;
故选:BC;
(3)根据实验装置原理,使用的仪器有:烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、漏斗,分液漏斗等,
故答案为:(普通)漏斗和分液漏斗;
(4)蒸馏实验中蒸馏烧瓶加热应垫石棉网;温度计测定温度为蒸汽的温度,温度计水银球应放在支管口处;为达到最佳冷凝效果冷凝水与蒸汽流向相反,即下口入,上口出;根据装置图可知,错误有:①缺石棉网;②温度计插到了液体中;③冷凝管进出水方向颠倒;
故答案为:①缺石棉网;②温度计插到了液体中;③冷凝管进出水方向颠倒;
(5)有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管,所以实验中使用水浴.碘是固态,因此最后晶体碘聚集在蒸馏烧瓶中;
故答案为:有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管;蒸馏烧瓶;
点评 本题以海水提碘为载体考查物质的分离和提纯,学习中注意掌握过滤、萃取、蒸馏等操作要点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的主要因素有浓度、压强、温度 | |
| B. | 容量瓶、量筒个滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;实验时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 为实验安全,金属钠切割下来的表层物质反应放回原试剂瓶,不能再研磨氯酸钾或硝酸钾 | |
| D. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬质酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是氧化还原反应 | |
| B. | 该反应的△H<0 | |
| C. | 生成新物质的化学式为 Fe2S3 | |
| D. | 生成新物质的总能量低于反应物铁粉和硫粉的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯( )、邻羟基苯甲醛( )、邻羟基苯甲醛(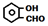 )熔沸点均于其对应对位取代物 )熔沸点均于其对应对位取代物 | |
| B. | 卤素元素的单质及其氢化物的熔沸点随原子半径的增大而升高 | |
| C. | 石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低 | |
| D. | NaCl、MgCl2、MgO、Al2O3熔沸点依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验步骤 | 实验现象 | 结论 |
| Ⅰ | 在两个蒸发皿中各加入10mL冷水,控制相同燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始到水沸腾的时间. | 用乙醇加热耗时118s;用汽油加热耗时56s. | 猜想2不成立 (填“成立”或“不成立”) |
| Ⅱ | 实验Ⅰ停止加热后,取下蒸发皿,观察蒸发皿的底部. | 用乙醇加热的蒸发皿底部只有及少量炭黑,而用汽油加热的蒸发皿底部有大量的炭黑. | 猜想1成立(可仿照上格填写) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com