
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是()
A. Na+、Fe2+、Cl﹣、ClO﹣ B. Na+、Cu2+、SO42﹣、NO3﹣
C. Mg2+、NH4+、SO42﹣、Cl﹣ D. Ba2+、HCO3﹣、NO3﹣、K+
考点: 离子共存问题.
分析: 强酸性溶液中存在大量氢离子,能够与氢离子反应的离子不能大量共存;无色溶液中不存在有色离子,
A.亚铁离子为有色离子,次氯酸根离子具有强氧化性,能够氧化亚铁离子;
B.铜离子为有色离子,不满足溶液无色的要求;
C.Mg2+、NH4+、SO42﹣、Cl﹣离子之间不发生反应,都不与氢离子反应,且为无色溶液;
D.碳酸氢根离子与氢离子反应生成二氧化碳气体和水.
解答: 解:A.Fe2+为有色离子,且ClO﹣能够氧化Fe2+,ClO﹣能够与氢离子结合生成次氯酸,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,不满足溶液无色的条件,故B错误;
C.Mg2+、NH4+、SO42﹣、Cl﹣离子之间不反应,都为无色离子,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.HCO3﹣与强酸溶液中的氢离子反应生成二氧化碳气体,在溶液中不能大量共存,故D错误;
故选C.
点评: 本题考查离子共存的判断,为2015届高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在.


科目:高中化学 来源: 题型:
下列化学用语正确的是()
A. Cl﹣的结构示意图: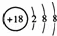
B. 质子数为53,中子数为78的碘原子: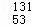 I
I
C. 光导纤维主要成分的化学式:Si
D. H216O、D216O、H218O、D218O互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是()

A. 原子半径的大小为:Z>Y>X
B. 气态氢化物的还原性:Z<Y
C. 若Y可作半导体材料,则X、Z的单质常温下均为气体
D. 若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作或发生事故时的处理方法正确的是()
A. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,再涂上3%~5%的小苏打溶液
B. 给试管里的液体加热时,试管应与桌面垂直
C. 配制一定物质的量浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线
D. 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值
查看答案和解析>>
科目:高中化学 来源: 题型:
已知M2O7x﹣+3S2﹣+14H+=2M3++3S↓+7H2O,则M2O7x﹣中的M的化合价为()
A. +2 B. +3 C. +4 D. +6
查看答案和解析>>
科目:高中化学 来源: 题型:
碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )
|
| A. | CCl4与I2分子量相差较小,而H2O与I2分子量相差较大 |
|
| B. | CCl4与I2都是直线型分子,而H2O不是直线型分子 |
|
| C. | CCl4和I2都不含氢元素,而H2O中含有氢元素 |
|
| D. | CCl4和I2都是非极性分子,而H2O是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 铅蓄电池放电时铅电极发生还原反应
B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C. 给铁钉镀铜可采用CuSO4作电镀液
D. 生铁浸泡在食盐水中发生析氢腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com