
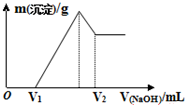
 ��0.1mol��þ�������������100mL 2mol/L H2SO4��Һ�У�Ȼ���ٵμ�1mol/L NaOH��Һ���ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯��ͼ��ʾ������˵������ȷ���ǣ�������
��0.1mol��þ�������������100mL 2mol/L H2SO4��Һ�У�Ȼ���ٵμ�1mol/L NaOH��Һ���ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | O��V1������Ӧ�����ӷ���ʽΪ��H++OH-�TH2O | |
| B�� | ��V1=160mLʱ��V2�����Ϊ360mL | |
| C�� | ��V1=160mLʱ�������������þ������Ϊ1.44g | |
| D�� | ��Mg2+��Al3+�պó�����ȫ��������NaOH��Һ�����Ϊ400mL |
���� A��0��V1�ε�������������Һ��û�����ɳ�����˵��������������������������ʣ������ᷴӦ���������ƺ�ˮ��
B����V1=160mLʱ����ʱ����Һ��MgSO4��Al2��SO4��3��Na2SO4���Һ��
��Na+�����غ��֪��n��Na2SO4��=$\frac{1}{2}$n��Na+��=$\frac{1}{2}$n��NaOH��=$\frac{1}{2}$��0.16L��1mol/L=0.08mol��
��MgSO4Ϊxmol��Al2��SO4��3Ϊymol����
����Mgԭ�ӡ�Alԭ���غ��У�x+2y=0.1��
100mL 2mol/L��H2SO4��Һ�к�����������ʵ���Ϊ��2mol/L��0.1L=0.2mol��
����SO42-�����غ��У�x+3y=0.2-0.08=0.12��
�������̽�ã�x=0.06��y=0.02��
���Խ�����ĩ�У�n��Mg��=0.06mol��n��Al��=2y=2��0.02mol=0.04mol��
�μ�NaOH��Һ�����V2ʱʱ����Һ��Na2SO4��NaAlO2���Һ������SO42-���ӡ�Na+���Ӻ�Alԭ���غ��У�
n��NaOH��=2n��Na2SO4��+n��NaAlO2��=2n��H2SO4��+n��Al��=2��0.2mol+0.04mol=0.44mol��
����c=$\frac{n}{V}$���м�����⣻
C����B��֪n��Mg��=0.06mol������m=nM���м��㣻
D����������ת��Ϊƫ��������ӵĹ�ϵʽΪ��Al��Al��OH��3��OH-����n��Al��=2y=2��0.02mol=0.04mol�����������������Ƶ����Ϊ��$\frac{0.04mol}{1mol/L}$=0.04L��
��� �⣺A��0��V1�Σ���������������Һ��û�����ɳ�����˵�����������������������������ᷴӦ���������ƺ�ˮ����Ӧ�����ӷ���ʽΪ��H++OH-=H2O����A��ȷ��
B����V1=160mLʱ����ʱ����Һ��MgSO4��Al2��SO4��3��Na2SO4���Һ��
��Na+�����غ��֪��n��Na2SO4��=$\frac{1}{2}$n��Na+��=$\frac{1}{2}$n��NaOH��=$\frac{1}{2}$��0.16L��1mol/L=0.08mol��
��MgSO4Ϊxmol��Al2��SO4��3Ϊymol����
����Mgԭ�ӡ�Alԭ���غ��У�x+2y=0.1��
100mL 2mol/L��H2SO4��Һ�к�����������ʵ���Ϊ��2mol/L��0.1L=0.2mol��
����SO42-�����غ��У�x+3y=0.2-0.08=0.12��
�������̽�ã�x=0.06��y=0.02��
���Խ�����ĩ�У�n��Mg��=0.06mol��n��Al��=2y=2��0.02mol=0.04mol��
�μ�NaOH��Һ�����V2ʱʱ����Һ��Na2SO4��NaAlO2���Һ������SO42-���ӡ�Na+���Ӻ�Alԭ���غ��У�
n��NaOH��=2n��Na2SO4��+n��NaAlO2��=2n��H2SO4��+n��Al��=2��0.2mol+0.04mol=0.44mol��
��V2=$\frac{0.44mol}{1mol/L}$=0.44L=440mL����B����
C����B��֪n��Mg��=0.06mol��m=nM=0.06mol��24g/mol=1.44g����C��ȷ��
D����������ת��Ϊƫ��������ӵĹ�ϵʽΪ��Al��Al��OH��3��OH-����n��Al��=2y=2��0.02mol=0.04mol�����������������Ƶ����Ϊ��$\frac{0.04mol}{1mol/L}$=0.04L�����Ե�Mg2+��Al3+�պó�����ȫ��������NaOH��Һ�����Ϊ440-40=400mL����D��ȷ��
��ѡB��
���� ���⿼�����йػ���ﷴӦ�ļ��㣬��Ŀ�Ѷ��еȣ���ȷͼ�����߱仯�ĺ���Ϊ��������Ĺؼ���ע�����ճ������ӵ����ʼ������ķ�Ӧ����������������ѧ���ķ�����������������ѧ����������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
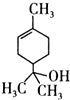 ��������˵��������ǣ�������
��������˵��������ǣ�������| A�� | 1mol����������ܺ�lmol���������ӳɷ�Ӧ | |
| B�� | ������������ | |
| C�� | ��������ʹ��ˮ��ɫ | |
| D�� | ����ʽΪC10H18O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӣ��ش��������⣺
X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �ѽ� | C�� | ���ѻ� | D�� | ��ȡ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ÿɽ���ġ��������ϡ����һ���Է��У��ɼ��ٰ�ɫ��Ⱦ | |
| B�� | ��ϩ��������ϩ����ʹ��ˮ��ɫ | |
| C�� | ����Ĥ��һ����ʳƷ������Ҫ�ɷ��Ǿ�����ϩ | |
| D�� | ������ά���ϳ���ά���ά�����л��߷��ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
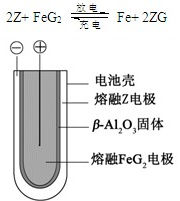
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ����е������������� | |
| B�� | ԭ��ظ����͵�������������������Ӧ | |
| C�� | �ڵ��������������ɵĵ缫���������� | |
| D�� | ���ʱ���Ʋ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com