
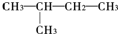 的一氯取代物的种数是( )
的一氯取代物的种数是( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
科目:高中化学 来源: 题型:解答题
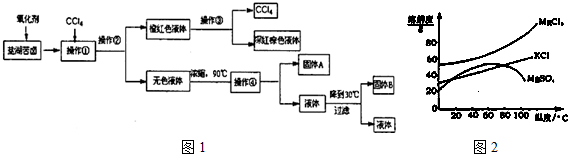
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 原电池是自发的氧化还原反应,电解池发生的是不自发的氧化还原发应 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大 | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它是苯酚的同系物 | |
| B. | 1mol该有机物能与溴水反应消耗2molBr2发生取代反应 | |
| C. | 1mol该有机物能与金属钠反应产生0.5molH2 | |
| D. | 1mol该有机物能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | <1:1 | C. | ≥1:1 | D. | 任意比 |
查看答案和解析>>
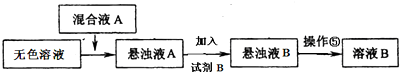
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
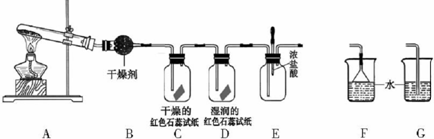
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质 Cl2、Br2、I2的氧化性强弱 | |
| B. | 气态氢化物 NH3、H2O、HF 的稳定性 | |
| C. | 碱金属单质 Li、Na、K 与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al 分别与足量盐酸反应时失电子数的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) 物质的量/(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com