
【题目】当今环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。请回答下列问题
(1)用还原法将NO转化为无污染的物质。已知:
2C(s)+O2(g)![]() 2CO △H1=-221.0KJ/mol
2CO △H1=-221.0KJ/mol
N2(g)+O2(g)![]() 2NO △H2=+180.5KJ/mol
2NO △H2=+180.5KJ/mol
2NO+C(s)![]() CO2(g)+N2(g) △H3=-573.75KJ/mol
CO2(g)+N2(g) △H3=-573.75KJ/mol
请写出CO与NO生成无污染气体CO2与N2的热化学方程式_______________________。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 500℃、T乙= 500℃、T丙= a℃

甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______500℃(填“”、“<”或“=”),理由是_______________________________。
(3)某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。

①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为_________。
②在n(NO)/n(CO)=1的条件下,为更好的除去NO物质,应控制的最佳温度在_____K左右。
(4)利用电解原理也可以处理NO。下图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则B为___________极(填“正”“负”“阴”或“阳”,),A电极反应式为______________________。

【答案】2CO(g)+2NO(g) ![]() 2CO2(g)+ N2(g)△H=-746.0 kJ/mol
2CO2(g)+ N2(g)△H=-746.0 kJ/mol ![]() > 甲、丙容器中反应物起始量相同,丙容器达平衡的时间比甲容器达平衡的时间短 NO的分解反应是放热反应,升高温度不利于正反应进行 870K(温度写到800K~900K之间均可) 阴极 SO2-2e+2H2O= SO42 +4H+
> 甲、丙容器中反应物起始量相同,丙容器达平衡的时间比甲容器达平衡的时间短 NO的分解反应是放热反应,升高温度不利于正反应进行 870K(温度写到800K~900K之间均可) 阴极 SO2-2e+2H2O= SO42 +4H+
【解析】
(1)根据盖斯定律进行分析;
(2)根据三段式,计算出平衡时各物质的浓度,根据平衡常数计算公式K= ![]() 进行计算;根据温度对反应速率的影响规律进行分析;
进行计算;根据温度对反应速率的影响规律进行分析;
(3)①根据温度对平衡移动的规律进行分析;
②在![]() =1的条件下,根据图像可知,温度在870K左右分解率几乎达到100%;
=1的条件下,根据图像可知,温度在870K左右分解率几乎达到100%;
(4)根据图示,A极SO2失电子发生氧化反应生成SO42,则A为阳极,发生氧化反应。
(1)已知:①2C(s)+O2(g)![]() 2CO △H1=-221.0kJ/mol
2CO △H1=-221.0kJ/mol
②N2(g)+O2(g)![]() 2NO △H2=+180.5kJ/mol
2NO △H2=+180.5kJ/mol
③2NO+C(s)![]() CO2(g)+N2(g) △H3=-573.75kJ/mol
CO2(g)+N2(g) △H3=-573.75kJ/mol
CO与NO生成气体CO2与N2的热化学方程式为2CO(g)+2NO(g) ![]() 2CO2(g)+ N2(g)△H,根据盖斯定律可知2③-(①-②)可得目标反应方程式,所以△H=-573.75kJ/mol×2-(-221.0kJ/mol-180.5kJ/mol)=-746.0 kJ/mol,所以该反应的热化学方程式为:2CO(g)+2NO(g)
2CO2(g)+ N2(g)△H,根据盖斯定律可知2③-(①-②)可得目标反应方程式,所以△H=-573.75kJ/mol×2-(-221.0kJ/mol-180.5kJ/mol)=-746.0 kJ/mol,所以该反应的热化学方程式为:2CO(g)+2NO(g) ![]() 2CO2(g)+ N2(g)△H=-746.0 kJ/mol;
2CO2(g)+ N2(g)△H=-746.0 kJ/mol;
(2)甲容器中,发生反应2NO(g)+C(s) ![]() CO2(g)+ N2(g),根据容器中cNO) (mol/L)随时间(s)的变化,列三段式:
CO2(g)+ N2(g),根据容器中cNO) (mol/L)随时间(s)的变化,列三段式:

根据平衡常数的定义可知K=![]() =
=![]() ;
;
甲、丙容器中反应物起始量相同,丙容器达平衡的时间比甲容器达平衡的时间短,反应速率更快,故丙容器的反应温度a > 500℃;
(3)①根据图像可知,温度超过775K,升高温度, NO的分解率降低,平衡逆向移动,则NO的分解反应为放热反应;
②在![]() =1的条件下,根据图像可知,温度在870K左右分解率几乎达到100%,且再继续升高温度,分解率变化不大;
=1的条件下,根据图像可知,温度在870K左右分解率几乎达到100%,且再继续升高温度,分解率变化不大;
(4)根据图示,A极SO2失电子发生氧化反应生成SO42-,则A为阳极,电极反应式是SO2-2e+2H2O=SO42-+4H+,则B为阴极。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 除去水垢中的![]() 常用试剂有碳酸钠和盐酸
常用试剂有碳酸钠和盐酸
B. 煤干馏可以得到焦炉气、粗氨水、芳香族化合物、焦炭等物质
C. 用碘水检验淀粉是否水解完全
D. 天然纤维、合成纤维和人造纤维组成元素完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在混合导体透氧膜反应器中一步同时制备氨合成气(N2、H2)和液体燃料合成气(CO、H2),其工作原理如图所示,下列说法错误的是
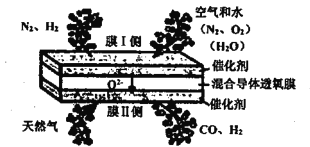
A. 膜I侧反应为: H2O+2e-=H2+O2- O2+4e-=2O2-
B. 膜II侧相当于原电池的负极
C. 膜II侧发生的反应为:CH4+O2--2e-=2H2+CO
D. 膜II侧每消耗1molCH4,膜I侧一定生成1mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
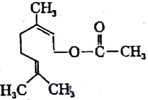
①1mol该有机物可消耗3molH2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A. ②③⑤ B. ①④⑤ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1L 1 mol·L-1 的NaHCO3溶液中含有的离子数为3NA
B.22.4 L的CO2与过量Na2O2充分反应转移的电子数为NA
C.常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知0.1molL﹣1HCl溶液中c(OH﹣)=1×10﹣11molL﹣1,现将0.2molL﹣1的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
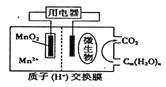
A. 正极反应式为MnO2+4H++2e-===Mn2++2H2O
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池阴极增重9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是![]() 受体拮抗剂
受体拮抗剂![]() 的中间体,Nakamura等人设计制备H的合成路线如图所示:
的中间体,Nakamura等人设计制备H的合成路线如图所示:
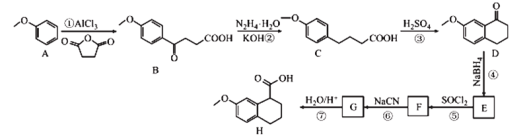
已知:Ⅰ.![]()
![]()
![]() ;
;
Ⅱ.![]() 。
。
回答下列问题:
(1)B中含氧官能团的名称为______________。
(2)F的分子式为![]() ,则F的结构简式为___________。
,则F的结构简式为___________。
(3)②⑤的反应类型分别为____________、____________。
(4)反应①的化学方程式为________________。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出化合物H与足量![]() 发生加成反应的产物的结构简式,并用星号(*)标出其中的手性碳:________________。
发生加成反应的产物的结构简式,并用星号(*)标出其中的手性碳:________________。
(6)Q与C互为同分异构体,Q遇![]() 溶液发生显色反应,且苯环上连有两个取代基,
溶液发生显色反应,且苯环上连有两个取代基,![]() 与足量
与足量![]() 溶液反应最多产生
溶液反应最多产生![]() ,则Q的同分异构体有_______种(不含立体异构);其中核磁共振氢谱有6组吸收峰的结构简式为____________(任写一种)。
,则Q的同分异构体有_______种(不含立体异构);其中核磁共振氢谱有6组吸收峰的结构简式为____________(任写一种)。
(7)参照上述合成路线和信息,设计以苯乙醛为原料(其他试剂任选)制备![]() 的合成路线:____________。
的合成路线:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com