
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
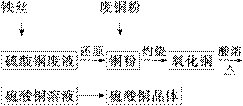 |
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有_____________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是______________
________________________________________________________________________。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
________________________________________________________________________。
解析 废铁丝中含有铁锈(Fe2O3·xH2O),所以在用稀硫酸处理时可能发生的反应有:Fe2O3+6H+===2Fe3++3H2O,2Fe3++Fe===3Fe2+,Fe+2H+===Fe2++H2↑;废铜粉在灼烧后得到的产物中含有单质铜,可能是原来杂质中含有C等还原性杂质导致;Cu在不断通入氧气和加热的条件下,可溶解于稀硫酸中,发生反应2Cu+O2+2H2SO42CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。
答案 (1)Fe2O3+6H+===2Fe3++3H2O,
2Fe3++Fe===3Fe2+,Fe+2H+===Fe2++H2↑
(2)C或CO 2CuO+C2Cu+CO2↑或CuO+COCu+CO2
(3)2Cu+O2+2H2SO42CuSO4+2H2O
(4)生成等量CuSO4晶体所消耗的H2SO4更多,且会产生污染大气的气体


科目:高中化学 来源: 题型:
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:__________________________________。
(3)写出下列物质的电子式:
①D元素形成的单质:___________________________________________________。
②E与B形成的化合物:_________________________________________________。
③A、B、E形成的化合物:_____________________________________________________。
④D与E形成的化合物:_____________________________________________。
⑤C、D、E形成的离子化合物:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积均为1 L的甲、乙两个恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B,相同条件下,发生下列反应:A(g)+B(g)xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )

A.甲容器中A的反应速率为0.1 mol·L-1·min-1
B.给甲容器加压可缩短反应达到平衡的时间
C.给乙容器升温可缩短反应达到平衡的时间
D.甲和乙中A的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子数之和是O原子数的5倍。
(1)A的分子式是________________。已知:各有机物间存在如下转化关系
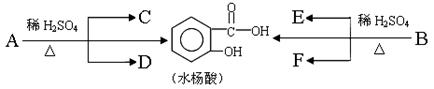 |
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类型的有机物。
(2)水杨酸中所含官能团的名称是____________;完全燃烧时,1 mol D与1 mol 下列有机物耗氧量相同的是____________(填字母代号)。
a. C3H6O3 b. C3H8O c. C2H4 d. C2H6O2
(3)B的结构简式是________________________;
水杨酸与小苏打溶液反应的化学方程式:_________________________________; 一定条件下,C与F反应的反应类型是____________。
(4)写出C与足量银氨溶液的反应化学方程式:________________________________;反应类型是____________。
(5)同时符合下列要求的化合物有____________种。
① 与A互为同分异构体 ② 可以水解
③ 苯环上有两个取代基,且苯环上的一氯代物只有1种
(6)1 mol上述(5)中的一种有机物X 在水溶液中,能与4 mol NaOH共热发生反应,写出此反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是 ( )。
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )
①只有Fe2+ ②Fe2+和Fe3+
③Fe2+和Cu2+ ④Cu2+和Fe3+
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。
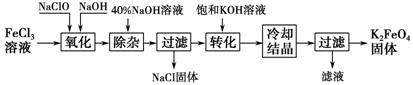
(1)完成“氧化”过程中反应的化学方程式:
FeCl3+____NaOH+____NaClO→____Na2FeO4+____+____。其中氧化剂是____(填化学式)。
(2)“转化”过程中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO,该电极反应方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
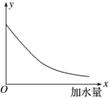
A.溶液中OH-的物质的量浓度
B.溶液的导电能力
C.溶液中的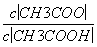
D.CH3COOH的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是________(填序号)。
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为________;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素为________(填元素符号)。
(3)A与C形成的非极性分子中,σ键与π键的个数之比为________;该分子与过量强碱反应生成的酸根离子的空间构型为________。
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,B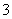 中心原子的杂化轨道类型为________。
中心原子的杂化轨道类型为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com