
 ②
②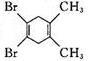 ③
③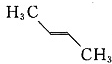 ④
④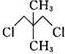
| A. | 0种 | B. | 1种 | C. | 2种 | D. | 3种 |
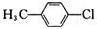
分析 化合物的核磁共振氢谱中出现2个峰说明有机物中含有2种类型的氢原子,根据等效氢判断.
分子中等效氢原子一般有如下情况:①分子中同一甲基上连接的氢原子等效,②同一碳原子所连甲基上的氢原子等效,③处于镜面对称位置上的氢原子等效.
解答 解:化合物的核磁共振氢谱中出现2个峰说明有机物中含有2种类型的氢原子,且原子数之比为3:2;
①分子中含有三种等效氢原子,应出现三种峰值,故①错误;
②分子中含有两种等效氢,出现两种峰值,且不同峰值的氢原子个数比为3:2,故②正确;
③分子中含有两种等效氢,出现两种峰值,且不同峰值的氢原子个数比为3:1,故③错误;
④分子中含有两种等效氢,出现两种峰值,且不同峰值的氢原子个数比为3:2,故④正确;
故选C.
点评 本题考查了有机化合物结构的分析判断,明确分子中的等效氢判断是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)?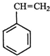 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)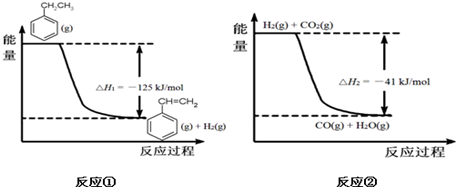
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$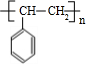 ,该聚合物的链节为
,该聚合物的链节为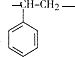 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
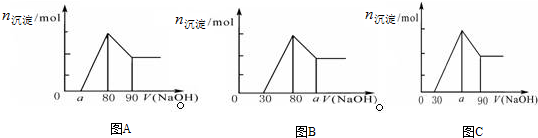
| A. | A图中a的取值范围为 0≤a<50 | |
| B. | A图中$\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
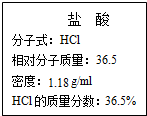 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
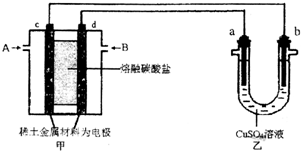
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、H+、Fe2+、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ④⑥ | C. | ③④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2S和SO2的混合气体中含有的分子总数为NA | |
| B. | 1 L pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA | |
| C. | 78g苯中含有碳碳双键的数目为3NA | |
| D. | 6.72L NO2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com