
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2﹣N2+HCl
①该反应中被氧化的元素是_____(填元素名称),氧化剂是_____(填化学式)。
②配平该方程式:_____NH3+_____Cl2=_____N2+_____HCl
(3)“地康法”制氯气的反应原理图示如下:
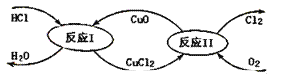
①反应I的化学方程式为_____。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为_____。
【答案】a 氮 Cl2 2 3 1 6 2HCl+CuO=CuCl2+H2O 1mol
【解析】
(1)a、滴水成冰,没有生成新物质,属于物理变化,符合题意,a正确;
b.蜡炬燃烧生成二氧化碳和水,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,b错误;
c.百炼成钢,为钢中的碳与氧气反应生成二氧化碳,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,c错误;
(2)①还原剂化合价升高,被氧化,氧化剂化合价降低,被还原;
②利用化合价升降法配平;
(3)①根据反应原理图,反应I是HCl、CuO反应生成CuCl2和H2O;
②标准状况下11.2L氯气的物质的量是0.5mol,反应I是非氧化还原反应,反应II是氧化还原反应,氯元素化合价由﹣1升高为0。
(1)a、滴水成冰,没有生成新物质,属于物理变化,符合题意,a正确;
b.蜡炬燃烧生成二氧化碳和水,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,b错误;
c.百炼成钢,为钢中的碳与氧气反应生成二氧化碳,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,c错误;
故答案为a;
(2)①NH3和Cl2反应中氮元素化合价由﹣3升高为0,氯元素化合价由0降低为﹣1,该反应中被氧化的元素是氮元素,氧化剂是Cl2;
②氮元素化合价由﹣3升高为0,氯元素化合价由0降低为﹣1,最小公倍数为6,根据得失电子守恒配平方程式是2NH3+3Cl2=N2+6HCl;
(3)①根据反应原理图,反应I是HCl、CuO反应生成CuCl2和H2O,反应方程式是2HCl+CuO=CuCl2+H2O;
②标准状况下11.2L氯气的物质的量是0.5mol,反应I是非氧化还原反应,反应II是氧化还原反应,根据2CuCl2+O2=2CuO+2Cl2,氯元素化合价由﹣1升高为0,所以生成0.5mol氯气转移1mol电子。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率
B. 食品包装材料聚乙烯因发生加成反应而易老化
C. ![]() 的名称为4—苯基—2—丁醇
的名称为4—苯基—2—丁醇
D. 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有四种物质:①氧化铁 ②硫酸 ③碳酸氢钠 ④氢氧化钠
①属于盐的是________(填序号),写出这种物质在水溶液中的电离方程式__________。
②上述物质中有一种与其他三种物质均能反应,此物质是__________(填序号)。
(2)酸性条件下,次磷酸(H3PO2)可发生下列反应而用于化学镀银。
口Ag++口H3PO2+口 =口Ag+口H3PO4+口
试回答下列问题
①该反应的氧化产物是_________。
②请将反应物和生成物补充完整并配平,并用双线桥法标出电子转移的数目。______
③若反应中生成10.8gAg,则转移电子的数目约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是

A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是
等。下列说法正确的是
A. ![]() 和
和![]() 的化学性质完全不同
的化学性质完全不同
B. 元素Ts的相对原子质量为![]()
C. 基态![]() 原子核外电子共占据7个能级
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,加“碘”食盐中添加较多的是碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极材料,以KI溶液为电解液,在一定条件下进行电解,反应的化学方程式为KI+3H2O![]() KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
A. 加碘食盐不能使淀粉溶液变蓝
B. 电解时,石墨作阳极,不锈钢作阴极
C. 阳极的电极反应式为I-+3H2O+6e-=IO3-+6H+
D. 转移3 mol电子,理论上可制得107 g KIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________,P、S、Cl的第一电离能由大到小顺序为____________________,P、S、Cl的电负性由大到小顺序为_______________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_______________________________。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______。
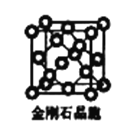
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某双原子分子构成的气体,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA。对质量为m g的该气体,求:(用含M、NA、m符号的式子表示)。
(1)在标准状况下,该气体的体积为________L,密度为________g·L-1。
(2)该气体所含的原子总数为________个。
(3)该气体的一个分子的质量约为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)通过不休眠种子与休眠种子胚的鲜重比较,得出其中结合水/自由水比值高的是_______种子;不休眠的种子萌发6天后至形成叶片前,干重会____________,原因是:____________。
(2)不休眠的种子萌发后胚中的RNA合成量____________,经分析种子的淀粉含量下降而葡萄糖含量升高,推测某些RNA控制翻译合成了______________。
(3)第5天萌发种子的胚根长出,此时整个种子内DNA的含量与不萌发种子比__________(相等、增多、减少),推测的理由是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com