
分析 (1)对固体、液体物质而言,粒子间的距离较小,不能忽略粒子大小,对于气体而言,粒子间距离较大,远大于粒子本身,温度压强影响微粒间距离;
(2)根据c=$\frac{1000ρw}{M}$计算出浓硫酸的物质的量浓度,再根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;结合配制一定物质的量浓度的溶液的步骤判断需要的仪器,若配制溶液时,玻璃棒和烧杯未洗干净,则所配溶液的浓度偏低,取配制后的溶液10mL溶液结合物质的量浓度计算溶质物质的量,依据化学方程式定量关系计算得到氢气物质的量,V=22.4n;
解答 解:(1)对固体、液体物质而言,粒子间的距离较小,不能忽略粒子大小,决定物质体积的因素主要为和粒子大小,对于气体而言,粒子间距离较大,远大于粒子本身,粒子大小可以忽略不计,决定物质体积的因素主要为构成物质的粒子数和粒子间的距离,外界条件不同,粒子间距离不同,与外界条件有关的是③,
故答案为:①②;①③;③;
(2)密度为1.8g•cm-3、98%的浓硫酸的物质的量浓度为:$\frac{1000×1.8×98%}{98}$mol/L=18mol/L,配制100mL2mol•L-1的 H2SO4溶液,需要浓硫酸的体积=$\frac{0.1L×2mol/L}{18mol/L}$=0.011L=11ml,需要的仪器有量筒、玻璃棒、胶头滴管、烧杯和100ml容量瓶,玻璃棒和烧杯未洗干净,溶质未转移到容量瓶中,则所配溶液的浓度偏低,取配制后的溶液10mL,溶液中溶质物质的量=0.01L×2mol/L=0.02mol,加入足量的锌,Zn+H2SO4=ZnSO4+H2↑,则生成标况下氢气物质的量为0.02mol,标准状况下的体积=0.02mol×22.4L/mol=0.448L,
故答案为:11;100ml容量瓶;偏低;0.448;
点评 本题考查了气体体积、气体摩尔体积、配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


科目:高中化学 来源: 题型:填空题
| AgNO3 | Ba(NO3)2 | AgCl | BaC12 | |
| H2O (液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ② | ⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
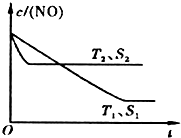 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石膏:CaSO4•2H2O,可用于制造各种模型 | |
| B. | 重晶石:BaCO3,可作白色颜料、医疗上“钡餐” | |
| C. | 绿矾:FeSO4•7H2O,可生产净水剂、防止缺铁性贫血的药剂 | |
| D. | 胆矾:CuSO4•5H2O,可用于生产农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3-->Al(OH)3 | B. | Cu-->CuCl2 | C. | Fe-->FeCl2 | D. | Na-->NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com