
(14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: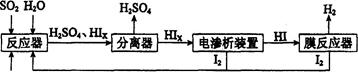
回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g) H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示: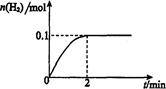
①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示: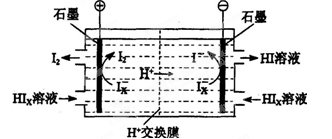
①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
| A.NH3生成的速率与NH3分解的速率相等 |
B.混合气体的反应速率 v正(NH3)=v逆(H2) v正(NH3)=v逆(H2) |
| C.容器内的密度不再变化 |
| D.单位时间内消耗a mol N2,同时生成2a mol NH3 |
 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列事实中,什么因素影响了化学反应的速率?
(1)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体。 。
(2)同浓度、同体积的盐酸中放入同样大小的锌粒和镁条,产生气体有快有慢。 。
(3)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同。 。
(4)工业上常将固体燃料粉碎进行燃烧。 。
(5)夏天的食品易霉变,冬天就不易发生该现象。 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。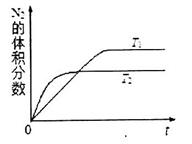
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。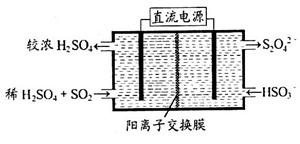
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L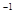 的醋酸与b mol
的醋酸与b mol L
L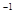 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0 (填“>”、“<”或“=”)。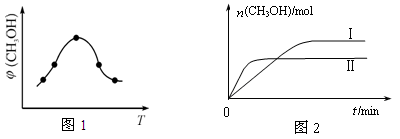
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。
当氨碳比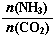 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)__________
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。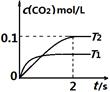
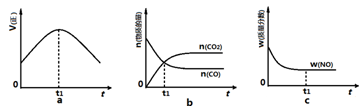
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。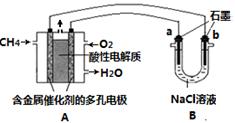
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度;
(3)用N2表示该反应的反应速率是多少;
(4)N2的转化率(保留三位有效数字);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com