
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

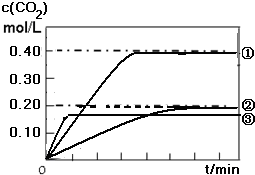
| 实验编号 | 窗口体积/L | 温度/℃ |
| ① | 1.0 | 1200 |
| ② | 2.0 | 1200 |
| ③ | 2.0 | 1300 |
| 6-X |
| 12+2X |
| C2(CO)?C2(H2) |
| C (CO2)?C(CH4) |
| 22×22 |
| 0.5×0.5 |
 ;
; ;
;

科目:高中化学 来源: 题型:
| A、Cu2+、H+、Cl- |
| B、CO32-、OH- Cl- |
| C、K+、H+、Cl- |
| D、K+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、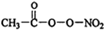 (PAN)等二次污染物.
(PAN)等二次污染物.| m |
| n |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验序号 | ||||
| 氢化铝产品粉末质量/g | 2.955 | 5.910 | 11.82 | 23.64 |
| 残留气体的体积/L(标准状况) | 2.24 | 2.24 | 4.48 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com