
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
分析 A.加入NaOH溶液共热,水解生成溴离子,检验溴离子应在酸性溶液中;
B.检验葡萄糖应在碱性溶液中;
C.乙醇易挥发,乙醇与反应生成的乙烯均能被高锰酸钾氧化;
D.铜丝在酒精灯上加热变黑后,生成CuO,CuO与乙醇反应生成乙醛、Cu、水.
解答 解:A.加入NaOH溶液共热,水解生成溴离子,检验溴离子应在酸性溶液中,则应加硝酸至酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成,故A错误;
B.酸性条件下水解生成葡萄糖,检验葡萄糖应在碱性溶液中,故B错误;
C.乙醇易挥发,乙醇与反应生成的乙烯均能被高锰酸钾氧化,应除杂后再检验乙烯的生成,故C错误;
D.铜丝在酒精灯上加热变黑后,生成CuO,CuO与乙醇反应生成乙醛、Cu、水,则铜丝恢复成原来的红色,实验能成功,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应为解答的关键,涉及离子检验、有机物水解反应、混合物分离提纯等,综合性较强,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
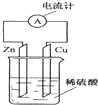
| A. | 电子由铜片通过导线流向锌片 | B. | 锌片逐渐溶解 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 1mol单质硅含有2NA个Si-Si键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com