
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
���� ��1�������ݷ�Ӧ�Է����е������ǡ�H-T��S��0�����жϣ�
���¶�����Kֵ��С����������ӦΪ���ȷ�Ӧ����CO��Ũ�ȱ仯Ϊc��������ʽ��ʾ�������ʱ仯��Ũ�ȡ�ƽ��ʱ��Ũ�ȣ��ٸ���ƽ�ⳣ�����㣻
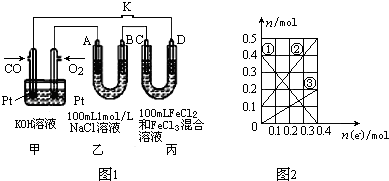
��2���������ǵ���Ȼ�����Һ���������������ӷŵ�������������������������ӷŵ��������������������֮�������������ӷŵ�����������ݴ˼��㣻
��C�缫Ϊ������D�缫Ϊ���������ݱ�ͼ��֪��Һ�������ֽ��������ӣ������ݱ��ijɷֿ�֪��Һ��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����C�缫��Cu��������D�缫��ʯī������������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯ȷ�����߶�Ӧ�����ӣ����ת�Ƶ��ӵ����ʵ������㣻
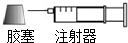
��3����ⷨ��������������ԭ���ǽ�NOx�ڵ����зֽ������Ⱦ��N2��O2��ȥ�����缫���ǹ������������ʣ���һ�������¿����ɴ���O2-������������ԭ��Ӧ����������NOx��õ�������N2��O2-��
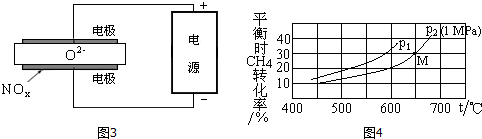
��4���÷�ӦΪ�����������ķ�Ӧ�����¶�һ��ʱ�����ݼ����ת������ѹǿ�Ĺ�ϵ���ж�ѹǿ��С��p2ʱM��ļ����ƽ��ת����Ϊ30%���ݴ˿ɼ����ƽ���Ƕ�ֻ���ʵ�Ũ�ȣ��ٸ�ƽ�ⳣ���Ķ�����м��㣻
��� �⣺��1����2CO��g���T2C��s��+O2��g����H=+221kJ•mol-1����Ӧ���ʱ������ر��С�ķ�Ӧ����H��0����S��0�����H-T��S��0����Ӧ�κ��¶��¶������Է����У�
�ʴ�Ϊ���÷�Ӧ���������ؼ��ķ�Ӧ���κ��¶��¾������Է����У�
���¶�����Kֵ��С����������ӦΪ���ȷ�Ӧ����H��0
���ڷ�Ӧ CO��g��+H2O��g��?H2��g��+CO2��g����
��ʼ��mol/L����0.02 0.02 0 0
�仯��mol/L����c c c c
ƽ�⣨mol/L����0.02-c 0.02-c c c
����$\frac{c��c}{��0.02-c����0.02-c��}$=9�����c=0.015��
����CO��ת����Ϊ$\frac{0.015mol/L}{0.02mol/L}$��100%=75%��
�ʴ�Ϊ������75%��
��2���������ǵ���Ȼ�����Һ���������������ӷŵ�������������������������ӷŵ��������������������֮�������������ӷŵ������������ת��0.4mol e-��
��������������Ϊ���������ʵ���Ϊ0.2mol������ͼ�����ݿ�֪�������ӵ����ʵ���Ϊ0.1mol�����Բ�������Ϊ0.05mol��ͬʱת��0.1mol���ӣ�����0.3mol�������ڲ������������ݵ缫��Ӧ4OH--4e-=2H2O+O2������֪�����������ʵ���Ϊ0.075mol����������װ���й���������������ʵ���Ϊ0.2mol+0.05mol+0.075mol=0.325mol��������������Ϊ7.28L��
�ʴ�Ϊ��7.28L��
�ڸ���ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ͭ���Ӵ������࣬���������ʵ�����С�������������ӣ���ΪFe3+����ΪFe2+����ΪCu2+������ת��Ϊ0.4mol���Ա�ͼ��֪��ʱ��Һ��ΪFe2+ 0.5mol����Cu2+����0.2mol����Ҫ����NaOH��Һ1.4mol�����Ϊ280ml��
�ʴ�Ϊ��280��
��3����ⷨ��������������ԭ���ǽ�NOx�ڵ����зֽ������Ⱦ��N2��O2��ȥ�����缫���ǹ������������ʣ���һ�������¿����ɴ���O2-������������ԭ��Ӧ����������NOx��õ�������N2��O2-���缫��ӦʽΪ��2NOx+4xe-=N2+2xO2-��
�ʴ�Ϊ��2NOx+4xe-=N2+2xO2-��
��4���÷�ӦΪ�����������ķ�Ӧ�����¶�һ��ʱ�����ݼ����ת������ѹǿ�Ĺ�ϵ���ж�ѹǿ��С֪p1ʱ�ļ����ת���ʴ��� p2 ʱ�ģ���ƽ��������Ӧ�����ƶ������ԣ�p1��p2��p2ʱM��ļ����ƽ��ת����Ϊ30%������ʼCH4��H2O�����ʵ�������Ϊamol��
����ݷ�Ӧ��
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ��mol�� a a 0 0
ת����mol�� 0.3a 0.3a 0.3a 0.9a
ƽ�⣨mol�� 0.7a 0.7a 0.3a 0.9a
����CH4��H2O��CO��H2ƽ���ѹ�ֱ�Ϊ$\frac{0.7a}{2.6a}$=$\frac{7}{26}$��$\frac{7}{26}$��$\frac{3}{26}$��$\frac{9}{26}$����KP=$\frac{\frac{3}{26}����\frac{9}{26}��^{3}}{\frac{7}{26}��\frac{7}{26}}$=0.066��
�ʴ�Ϊ������ 0.066��
���� ���⿼���˵��ԭ���ķ���Ӧ�á���Ӧ�Է����е��ж����ݡ���ѧƽ�ⳣ���ļ���ȣ����ջ����ǹؼ�����Ŀ�ѶȽϴ���ʱע��������Ϣ��������ã�


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����Ƽ����� | ���ӷ���ʽ |
| ����ʢ��2mlCuSO4��Һ���Թ������2mlNaOH��Һ���۲����� | Cu2++2OH-�TCu��OH��2�� |
| ����ʢ��2mL pH=1��HCl��Һ���Թ�����������18mL����������CH3COONH4��Һ��������֪CH3COONH4����Һ������ ����ҡ�ȣ����pH��3.7 | |
| ����ʢ��2mLNaHCO3��Һ���Թ������2mL H2SO4��Һ���۲����� | HCO${\;}_{3}^{-}$+H+�TH2O+CO2�� |
| ����ʢ��2mL ϡNa2SO4��Һ���Թ������2mLϡKCl��Һ���۲����������� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Ʒ��Na2O2�ĺ�����
����Ʒ��Na2O2�ĺ�����
| m��Ʒ | m�������� | m��NaCl�� |
| 8.00g | 0.42g | 10.53g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L 0.1 mol•L-1��CuCl2��Һ�к�Cu2+Ϊ0.1NA | |
| B�� | ��״���£�22.4 L CCl4��CCl4����ΪNA | |
| C�� | 1mol H3O+��������Ϊ10 NA | |
| D�� | 1mol Na2O2������к������ӵ���ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ����������еζ��ܡ���ƿ���ζ��ܼм�̨ | |
| B�� | ��ѡ�������ָʾ��������ʳ����CH3COOHŨ��ƫ�� | |
| C�� | �ζ�֮ǰ�IJ�����ѡ�ιܡ���©��ˮϴ����ϴ��װҺ����Һ�桢���� | |
| D�� | ��ʼ���Ӷ������յ�ʱ���Ӷ��������ʳ����CH3COOHŨ��ƫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �κ����嵥���ڱ�״�������ԼΪ22.4L������2NA��ԭ�� | |
| B�� | ���³�ѹ�£�16g������32 g������O3��������ԭ������Ϊ3NA | |
| C�� | ���³�ѹ�£�11.2L�����к��е���ԭ����Ϊ2NA | |
| D�� | ��״���£�0.3mol������̼�к�����ԭ����0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵ���ɫ���� | B�� | ���ʵ��۷е����� | ||
| C�� | ���ʵ��ܶ���С | D�� | ������ˮ�е��ܽ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
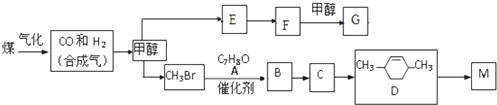
 +RX$\stackrel{����}{��}$
+RX$\stackrel{����}{��}$ +HX���������գ�
+HX���������գ� 2HCHO+2H2O��
2HCHO+2H2O��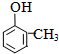 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com