
一定温度时,向饱和的BaSO4溶液中加水,下列叙述正确的是 ( )
A.BaSO4溶解度增大,Ksp不变
B.BaSO4溶解度、Ksp均增大
C.BaSO4溶解度不变,Ksp增大
D.BaSO4溶解度、Ksp均不变
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
有关氨气的实验较多,下面对这些实验原理的分析中,正确的是( )
A、氨气极易溶于水,可以用来做喷泉实验
B、氨气的还原性可以解释氨气与氯化氢的反应实验
C、NH3·H2O不稳定,实验室可用NH4Cl和石灰水制取氨气
D、NH3液化时放出大量的热,因而,不能用氨作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
向恒温、恒容(2L)的密闭容器中充入2molX和一定量的Y,发生反应:2X(g)+Y(g) 2Z(g)
2Z(g)
ΔH<0,4min后达到平衡c(X)=0.2mol·L-1,且X与Y的转化率相等。下列说法中不正确的是( )
A.达到平衡时,再充入1molX,反应的焓变保持不变
B.用Y表示4min内的反应速率为0.1 mol·L-1·min-1
C.再向容器中充入1molZ,达到新平衡,c(X)∶c(Y)=2∶1
D.4min后,若升高温度,平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是 ( )
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c (C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H = + 74.9 kJ·mol-1,下列说法中正确的是 ( )
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:

(1)800℃时。0—5min内,以B表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,
该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol, n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是 ( )
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c (C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
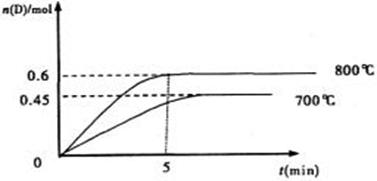
(1)800℃时。0—5min内,以B表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,
该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol, n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)
查看答案和解析>>
科目:高中化学 来源: 题型:
反应N2+3H2 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为
5 mol/L,3 min后测得NH3浓度为0. 6 mol/L,则此时间内,下列反应速率表示正确的是
A.v(H2)=0. 3 mol/(L·min) B.v(N2)=1. 0 mol/(L·min)
C.v(N2)=0. 3 mol/(L·min) D.v(H2)=1. 67 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com