
分析 根据n=$\frac{VL}{22.4L/mol}$计算出标准状况下V L HCl气体的物质的量,然后根据m=nM计算出HCl的质量,1L水的质量约为1000g,从而可知所得溶液的质量,再根据V=$\frac{m}{ρ}$计算出所得溶液的体积,最后根据c=$\frac{n}{V}$计算出该溶液的物质的量浓度.
解答 解:标准状况下VL HCl的物质的量为:n(HCl)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,该HCl的质量为:m(HCl)=36.5g/mol×$\frac{V}{22.4}$mol=$\frac{36.5V}{22.4}$g,1L水的质量约为1000g,则所得溶液的质量为:$\frac{36.5V}{22.4}$g+1000g=(1000+$\frac{36.5V}{22.4}$)g,
该溶液的体积为:$\frac{(1000+\frac{36.5V}{22.4})g}{dg/mL}$=$\frac{22400+36.5V}{22.4d}$mL,
所以该溶液的物质的量浓度为:c(HCl)=$\frac{n}{V}$=$\frac{\frac{V}{22.4}mol}{\frac{22400+36.5V}{22.4d}×1{0}^{-3}L}$=$\frac{1000Vd}{22400+36.5V}$mol/L,
故答案为:$\frac{1000Vd}{22400+36.5V}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算所得溶液体积为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3 | |
| B. | 配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3 | |
| D. | 在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液都有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
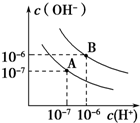 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
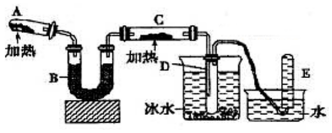 己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
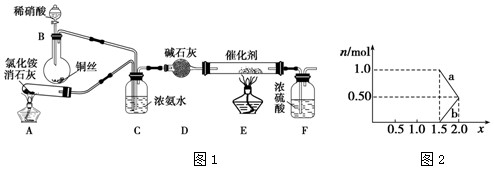
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com