
分析 (1)铜片的稀盐酸中加入H2O2后,铜片溶解,发生氧化还原反应生成氯化铜、水;
(2)依据氧化还原反应得失电子守恒规律计算解答;
(3)先由棕黄色变为浅绿色,过一会又变为棕黄色,则Fe3+先被还原后又氧化;(4)NaClO具有很强的氧化性,可以将Fe(NO3)3氧化成Na2FeO4,自身被还原成NaCl,据此书写方程式.
解答 解:(1)浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,发生氧化还原反应生成氯化铜、水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O,故答案为:Cu+2H++H2O2=Cu2++2H2O;
(2)300mL 0.3mol/L的KI溶液,碘离子的物质的量为0.09mol,依据题意0.09 mol I-→0.03mol I2+0.03IO3-共转移0.24 mol电子,MnO4-→Mn2+,化合价由+7价降低为+2价,设消耗KMnO4的物质的量为n,由电子守恒得:n×5=0.24mol,解得n=0.048 mol;
故答案为:0.048;
(3)先由棕黄色变为浅绿色,过一会又变为棕黄色,则Fe3+先被还原后又氧化,先变为浅绿色的离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,后变为棕黄色的原因是H+与NO3-组成的硝酸将Fe2+氧化成Fe3+,
故答案为:先由棕黄色变为浅绿色,Fe3+先被SO32-还原成Fe2+,后变为棕黄色的原因是H+与NO3-组成的硝酸将Fe2+氧化成Fe3+;
(4)NaClO具有很强的氧化性,可以将Fe(NO3)3氧化成Na2FeO4,自身被还原成NaCl,则发生的化学方程式为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O,
故答案为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
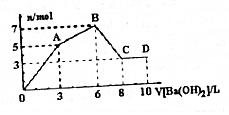 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是AlO2- | |
| B. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | 向D点溶液中通入过量CO2气体,最终将得到9mol沉淀 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③② | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | CH2=CH2+H2$→_{△}^{催化剂}$CH3-CH3 | ||
| C. |  +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ | D. |  +HNO3(浓)$\stackrel{浓H_{2}SO_{4}}{→}$ +HNO3(浓)$\stackrel{浓H_{2}SO_{4}}{→}$ NO2+H2O NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
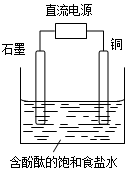
| A. | 石墨电极附近溶液呈红色 | B. | 铜电极上发生还原反应 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚晶体隔绝空气密封保存 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在乙醇中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com