
 如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图如图2,请根据图示回答下列问题:
如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图如图2,请根据图示回答下列问题:分析 (1)由仪器的结构可知,A为蒸馏烧瓶;
(2)温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水;
(3)沸石可以防止暴沸.
解答 解:(1)由仪器的结构可知,A为蒸馏烧瓶;故答案为:蒸馏烧瓶;
(2)温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,
故答案为:温度计水银球的位置错误;冷凝管中冷却水的流通方向错误;
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是防止液体暴沸,故答案为:防止液体暴沸.
点评 本题考查实验室制备蒸馏水的操作,题目难度不大,学习中要注重化学实验基本操作方法,本题中要特别注意温度计位置.


科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 单质沸点:X>Y>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子半径:Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| B. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性:2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O | |
| C. | 以石墨作电极电解氯化镁溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 碳酸氢钠溶液加入氯化铝溶液 3HCO3-+Al3+?3CO2↑+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键比分子间作用力强,所以它属于化学键 | |
| B. | 分子内形成的氢键使物质的熔点和沸点升高 | |
| C. | 氨溶于水后氨分子和水分子之间形成了氢键 | |
| D. | 邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (Ⅰ)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(Ⅰ)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答: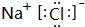 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
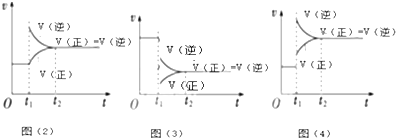
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
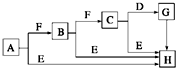 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
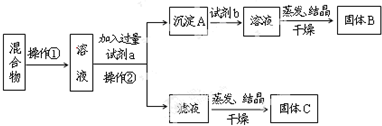
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com