
 N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达平衡后,与第一次平衡时相比,NO2的体积分数  课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
 (2013?广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(2013?广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: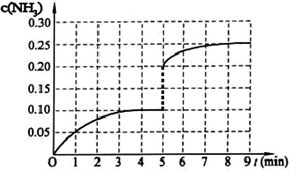

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届湖南望城一中、长沙县实验中学高三10月联考化学试卷(带解析) 题型:填空题
(10分)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
⑴根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)=______________________________
⑵该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶下列描述中能说明上述反应已达平衡的是___________。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中气体的平均相对分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com