
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
A.①④②⑤③B.④①②⑤③C.②⑤④①③D.⑤②④③①
【答案】C
【解析】
镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀。至于先除镁离子,还是先除硫酸根离子都行。钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:⑤加过量的BaCl2溶液,④加过量的Na2CO3溶液,②加过量的NaOH溶液,①过滤,③加适量的盐酸;或者,②加过量的NaOH溶液,⑤加过量的BaCl2溶液,④加过量的Na2CO3溶液,①过滤,③加适量的盐酸。所以正确的顺序是⑤④②①③或②⑤④①③,故答案为C。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质:(用序号填空)
① O2和O3 ; ②12C 与14C; ③ CH3 (CH2) 3 CH3和![]()
④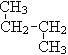 和
和![]() ;
;
(1)互为同位素的是_______ ;(2)互为同素异形体的是________;
(3)互为同分异构体的是________;(4)属于同一物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题。
(1)重铬酸钾(K2Cr2O7为橙色,K2CrO4为黄色)溶液存在着如下平衡:Cr2O72-+H2O ![]() 2CrO42-+2H+。
2CrO42-+2H+。
①若平衡体系的pH=2,则溶液显___________色。
②能说明该反应达平衡状态的是___________。
a.溶液呈酸性 b.溶液的颜色不变
c.2v(Cr2O72-)=v(CrO42-) d.Cr2O72-和CrO42-的浓度相同
(2)25℃时,2NO2(g)![]() N2O4(g)△H=-56.9kJ/mol。
N2O4(g)△H=-56.9kJ/mol。
①该反应的化学平衡常数表达式_________________________________。
②其它条件不变,缩小容器体积,达到新平衡,此过程的现象:
_______________________________________________________。
③其它条件不变,将该体系升温至100oC,此过程的现象:
_____________________________________________。
(3)明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。
①用离子方程式表示净水的原因:_________________________。
②明矾溶液中滴加Ba(OH)2溶液至SO42- 刚好沉淀完全时,溶液的pH______7(填“>”“=”或“<”,下同)。
③明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全时,溶液的pH______7。
④明矾溶液中离子浓度由大到小的顺序:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以化合物1为原料,按下列路线制备聚合物8。

已知:R—X![]() R—CN
R—CN![]() R—COOH
R—COOH
R—CH2COOH![]()
![]()
请回答:
(1)以下四个化合物中,含有羧基的是
A.化合物3 B.化合物4 C.化合物6 D.化合物7
(2)化合物4→8的合成路线中,未涉及的反应类型是
A.取代反应 B.消去反应 C.加聚反应 D.还原反应
(3)下列四个化合物中,与化合物4互为同系物的是
A.CH3COOC2H5B.C6H5COOH
C.CH3CH2CH2COOH D.CH3COOH
(4)化合物4的属于酯类的所有同分异构体的结构简式 。
(5)化合物7→8的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式______。
(2)离子半径:B____A(填“大于”或“小于”)。
(3)C原子的电子排布图是____,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈____形。
(4)D原子电子所占原子轨道数为_______个,D﹣的结构示意图是_____。
(5)BD3的水溶液显______性,原因_____________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

选项 | ①试剂 | ①中现象 | 解释 |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性: H2SO3 >H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成 白色BaSO3沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法正确的是

A. 电子由X极通过外电路移向Y极
B. 电池工作时,Li+通过离子导体移向b区
C. 负极发生的反应为:2H++2e-=H2↑
D. Y极每生成1 mol Cl2,a区得到2 mol LiCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si___ Ge(用“>”或“<”表示)。
②若锗位于Si的下一周期,写出“锗”在周期表中的位置_____。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______.
③硅和锗单质分别与![]() 反应时,反应较难进行的是_______(填“硅”或“锗”)。
反应时,反应较难进行的是_______(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试写出镓原子的结构示意图____。冶炼金属镓通常采用的方法是_____.
②已知Ga(OH)3难溶于水,为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________.
(3)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止:
该同学查找三种元素在周期表的位置如图所示:
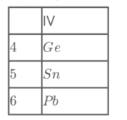
根据以上信息推测,下列描述正确的是______(填标号)。
a.锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4
b.锗、锡、铅的金属性依次减弱;
c. 锗、锡、铅的原子半径依次增大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、CO、![]() 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。
已知:![]()
![]()
![]()
![]()
![]()
![]()
(1)某反应的平衡常数表达式为 ,此反应的热化学方程式为:______。
,此反应的热化学方程式为:______。
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是______(填序号)。
a.容器中的压强保持不变 b.![]()
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
Ⅱ.(3)甲烷转化为![]() 和CO的反应为:
和CO的反应为:![]()
![]()

①一定条件下,![]() 的平衡转化率与温度、压强的关系如图所示。则
的平衡转化率与温度、压强的关系如图所示。则![]() ______
______![]() (填“<”“>”或“=”);
(填“<”“>”或“=”);
A、B、C三点处对应的平衡常数(![]() 、
、![]() 、
、![]() ),由大到小的顺序为______。
),由大到小的顺序为______。
②将![]() 和
和![]() 按等物质的量混合,一定条件下反应达到平衡,
按等物质的量混合,一定条件下反应达到平衡,![]() 转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为______。
转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为______。
Ⅲ.含![]() 的烟气可用
的烟气可用![]() 溶液吸收。
溶液吸收。
(4)已知![]() 时由
时由![]() ,和
,和![]() 形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为______。(已知
形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为______。(已知![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() )
)
(5)可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为______(任写一个)。离子交换膜______(填标号)为阴离子交换膜。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com